 BUSCAR
BUSCAR
 ÍNDICE
ÍNDICE
RESOLUCIÓN 1140 DE 2022
(julio 2)
<Fuente: Archivo interno entidad emisora>
<Rige a partir de su publicación>
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
<NOTA DE VIGENCIA: Resolución derogada por el artículo 3 de la Resolución 986 de 2023>
Por la cual se adoptan nuevos lineamientos para la aplicación de las vacunas contra la COVID-19
EL MINISTRO DE SALUD Y PROTECCIÓN SOCIAL
En ejercicio de sus facultades, especialmente de las conferidas por el literal b del artículo 488 de la Ley 9 de 1979, los numerales 3 del artículo 173 de la ley 100 de 1993, 42.1 del artículo 42 de la ley 715 de 2001, 3, 4 y 9 del artículo 2 del Decreto Ley 4107 de 2011 y 19.1 del artículo 19, parágrafos 6 y 9 del artículo 7 del Decreto 109 de 2021 y en desarrollo del inciso segundo del artículo 592 de la Ley 9 de 1979, del parágrafo del artículo 9 de la Ley 2064 de 2020, y
CONSIDERANDO:
Que la pandemia por la que atraviesa el mundo ocasionado por la COVID - 19 ha causado una gran afectación a la salud de todos los individuos, teniendo en cuenta los reportes de contagios, enfermos y muertes por esta causa; y a que adicionalmente a generado una crisis social de tipo global teniendo en cuenta las repercusiones económicas que han tenido las diferentes medidas contempladas para detener o contener la propagación de este virus.
Que ante esta situación, los países han abordado de diferente manera los desafíos que este virus representa y se han tomado decisiones en salud pública de una amplia repercusión en la vida cotidiana de las personas.
Que las vacunas contra COVID-19 representaron una nueva esperanza para poder detener la propagación de este virus, y para lo cual los gobiernos a nivel global encaminaron esfuerzos en lograr la mayor protección de la población frente al virus a través de la aplicación de estas vacunas.
Que, por lo anterior el Gobierno Nacional, entre otras medidas, adoptó el Plan Nacional de Vacunación definido por el Decreto 109 de 2021, modificado a su vez por los Decretos 404, 466, 630 y 744 de 2021 y 416 de 2022, en el cual fue necesario priorizar la inmunización acorde a las fases allí definidas, ante la poca oferta de estos biológicos en el mercado mundial, y a medida que se avanzaba en el plan y se aumentaba la provisión de estos insumos se pudo realizar la unificación de las diferentes etapas, permitiendo la masificación de la vacunación; en su última modificación se resaltó la importancia de priorizar la aplicación del biológico a las personas que lo soliciten, por encima del riesgo de que queden dosis sobrantes en el vial que puedan no ser utilizadas al final de la vida útil del frasco, evitando así la pérdida de la oportunidad de vacunación, de acuerdo con la política de frascos abiertos emitida por la Organización Mundial de la Salud.
Que, para la implementación del mencionado decreto, se realizó la adquisición de vacunas de diferentes plataformas y características, las cuales se han entregado a las entidades territoriales del orden departamental y distrital para su distribución a municipios e IPS con el fin de que fueran usadas para la inmunización de la población objeto, de manera escalonada y acompañada de otras medidas dirigidas a la prevención de la enfermedad.
Que para efectos de permitir la utilización de los biológicos en el país, el Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA ha emitido una Autorización de Uso de Emergencia ASUE, para los laboratorios que a su juicio cumplen con los requisitos necesarios, tal es el caso de ASTRAZENECA autorizada mediante la Resolución 2021005436 del 23 de febrero de 2021 con ASUE 2021 - 000002 para la vacuna contra covid-19 (ChAdOx1-S" recombinante o AZD1222, JANSSEN CILAG S.A. autorizada a través de la Resolución 2021010278 de 25 de marzo de 2021, la cual fue corregida mediante la Resolución 2021023282 de 11 de junio de 2021; VACUNA SARS-COV-2 (CELULA VERO), INACTIVADA - CORONAVAC, actualizada mediante Resolución 2021048566 de 29 de octubre de 2021 la Autorización Sanitaria de Uso de Emergencia - ASUE por parte del Invima.
Que, por su parte, para la vacuna Pfizer-BioNTech COVID-19 Vaccine su uso fue autorizado a través de la Resolución 2021000183 del 5 de enero del 2021, ASUE 2021-000001 a favor de PFIZER Inc; para el caso de la vacuna SPIKEVAX COVID- 19 VACCINE MODERNA, Resolución 2021025857 del 25 de junio de 2021 fue autorizada mediante Resolución 2021025857 del 25 de junio de 2021, ASUE 2021000005, modificada por la Resolución 2022008904 del 27 de abril de 2022.
Que, para la ejecución del Plan Nacional de Vacunación este Ministerio expidió la Resolución 197 de 2021, por medio de la cual se adoptaron los lineamientos técnicos y operativos para la vacunación contra la COVID-19, la cual se ha actualizado a través de las Resoluciones 430 y 1151 de 2021, esta última modificada por las Resoluciones 1866, 1887 de 2021, 092, 419, 661 y 762 de 2022, conforme a la evolución de la pandemia y la evidencia científica sobre la vacuna.
Que según el reporte diario de dosis aplicadas de las vacunas contra el COVID-19, enviado por cada entidad territorial y consolidado por la Dirección de Promoción y Prevención del Ministerio de Salud y Protección Social y en el marco de la implementación del plan, con corte al 14 de junio en el país se han recibido 99.166.854 dosis de vacunas contra el COVID-19, incluyendo las 2.100.000 dosis adquiridas por el sector privado, de las cuales se han asignado a las entidades territoriales 87.309.000 y se han aplicado 85.483.932 dosis, con corte al 14 de junio de 2022, de las cuales 42.512.130 corresponden a primeras dosis y 36.135.227 a esquemas completos.
Que, con corte a 14 de junio de 2022, el 83,3% de la población colombiana ha recibido al menos una dosis de la vacuna contra el COVID-19, el 70.8% de la población ha completado su esquema de vacunación y el 6% ha recibido su refuerzo.
Que si bien en un inicio del Plan Nacional de Vacunación las vacunas resultaron un insumo de difícil acceso por parte del país y con un elevado riesgo de pérdidas por hurtos y ello conllevó a requerir en esos momentos un acompañamiento de la fuerza pública para proteger su distribución y almacenamiento; este riesgo disminuyó en razón al aumento en las coberturas de vacunación, por lo que ya no resulta indispensable el acompañamiento de la fuerza pública para su custodia.
Que en sesión del 16 de junio de 2022 el Comité Asesor para el Proceso Estratégico de Inmunización de la Población Colombiana frente a la COVID-19, analizó y recomendó la aplicación de un segundo refuerzo de la vacuna a la población entre 12 y 49 años por recomendación médica.
Que, con la integración de las fases del plan nacional de vacunación, se logró un importante avance en las coberturas, lo cual ha disminuido la percepción del riesgo frente al evento, representándolo nuevo desafío al tener que buscar a las personas que aún no acceden a su vacunación para iniciar o completar esquemas que permitan tener más personas protegidas frente a posibles complicaciones o muertes de llegar a contraer la enfermedad.
Que, ante esta disminución de la demanda de vacunación, se deben realizar ajustes en la estrategia de vacunación con el fin de garantizar una masificación de la oferta de vacunas a nivel territorial y de IPS, así como para incluir aspectos administrativos para la solicitud, distribución y traslado de vacunas y aspectos técnicos relacionados con las recomendaciones para la aplicación y reporte de la vacunación.
Que dado que, en desarrollo de programas de vacunación, durante su fase operativa se pueden presentar situaciones en las que se configuran pérdidas de dosis de vacunas, se hace necesario adicionalmente estandarizar en el presente lineamiento los mecanismos para su reporte y seguimiento con fundamento en la política de frascos abiertos.
Que, en mérito de lo expuesto,
RESUELVE:
ARTÍCULO 1. OBJETO. <Resolución derogada por el artículo 3 de la Resolución 986 de 2023> La presente resolución tiene por objeto establecer nuevos lineamientos para la vacunación contra la COVID-19 contenidos en los siguientes anexos técnicos, los cuales hacen parte integral de la presente resolución:
Anexo 1: Lineamientos técnicos y operativos para la vacunación contra la COVID- 19.
Anexo 2: Consentimiento informado para la aplicación de la vacuna contra el SARS- CoV-2/COVID-19.
Anexo 3: Anexo técnico para la aplicación de la vacuna BNT162b2 Pfizer-BioNTech contra la COVID-19
Anexo 4: Anexo técnico para la aplicación de la vacuna CoronaVac de Sinovac Biotech contra la COVID-19
Anexo 5: Anexo técnico para la aplicación de la vacuna Oxford-AstraZeneca AZD1222 (CHADOX1-S/NCOV-19) contra la COVID-19
Anexo 6: Anexo técnico para ¡a aplicación de la vacuna AD26.COV2.S JANSSEN contra la COVID-19
Anexo 7: Anexo técnico para la aplicación de la vacuna MODERNA RNAM-1273 contra la COVID-19
ARTÍCULO 2. ÁMBITO DE APLICACIÓN. <Resolución derogada por el artículo 3 de la Resolución 986 de 2023> Las disposiciones contenidas en el presente acto administrativo aplican a entidades territoriales departamentales, distritales y municipales, entidades promotoras de salud de los regímenes contributivo y subsidiado, Entidades Adaptadas en Salud, a los prestadores de servicios de salud, los administradores de los regímenes Especial y de Excepción en salud y sus operadores, al Fondo Nacional de Salud de las personas privadas de la libertad y su operador.
ARTÍCULO 3. VIGENCIA. La presente resolución rige a partir de su publicación y deroga las Resoluciones 1151, 1866, 1887 de 2021, 092, 419, 661 y 762 de 2022.
PUBLÍQUESE Y CÚMPLASE
Dada en Bogotá, D. C., 1 JUL.2022
FERNANDO RUIZ GOMEZ
Ministro de Salud y Protección Social
LINEAMIENTOS TÉCNICOS Y OPERATIVOS PARA LA VACUNACIÓN CONTRA LA COVID-19.
INTRODUCCIÓN
La COVID-19 es la enfermedad causada por el nuevo coronavirus conocido como SARS-CoV-2 altamente contagiosa, dadas las mutaciones del agente causal como un evento natural y esperado dentro del proceso de evolución de los virus. La pandemia de la COVID-19 ha causado considerables daños a nivel mundial, por lo que contar con una vacuna segura y eficaz a contribuido a la reducción del número de casos de hospitalizaciones y fallecimientos relacionados con la infección, así mismo ha permitido restaurar gradualmente las actividades sociales y económicas del país, la región y el mundo.
Para la implementación de la vacunación contra la COVID-19 en Colombia, el Gobierno nacional promulgó el Decreto 109 de 2021 que estableció el Plan Nacional de Vacunación -PNV, modificado por los Decretos 404, 466, 630, 744, 1671 todos de 2021 y 416 de 2022, estableciendo como objetivos reducir la mortalidad y la incidencia de casos graves por la COVID-19.
Para su ejecución se suscribieron acuerdos de compra y se recibieron vacunas de diferentes plataformas:
| Fabricante | Plataforma |
| BNT1062B2 Pfizer Inc y BioNTech | ARN mensajero |
| Sinovac Life Scienses Co Ltd. denominada CoronaVac | Virus inactivado |
| Janssen Pharmaceutica NV | Vector de Adenovirus humano |
| Moderna ARNm-1273, Switzerland GmbH | ARN mensajero |
| ChAdOx1-S* recombinante o AZD1222 del laboratorio AstraZeneca | Vector de adenovirus |
Las condiciones establecidas para la vacunación contra la COVID-19, se han modificado a medida que avanzó el desarrollo del PNV, en ese sentido se logró la integración de fases y etapas que contribuyó a la disminución de la incidencia de la enfermedad y la mortalidad concomitante con el aumento de la protección a través de la vacunación y la inmunidad colectiva.
Como es de esperarse y en consecuencia a esta disminución, y -la percepción del riesgo, la demanda de la población en puntos masivos de vacunación contra COVID-19 ha descendido, sin embargo, aún en el país existe alrededor de 20 millones de personas susceptibles que no han iniciado, continuado o terminado sus esquemas de vacunación contra el COVID-19.
a. Establecer lineamientos técnicos y operativos para la vacunación contra la COVID-19.
b. Definir los aspectos técnicos y operativos para la vacunación contra la COVID-19 en el territorio nacional, dirigido a los actores del Sistema General de Seguridad Social en Salud.
c. Definir las responsabilidades de los actores del Sistema General de Seguridad Social en Salud para la vacunación contra la COVID-19.
d. Orientar técnicamente a los actores del Sistema General de Seguridad Social en Salud para garantizar la logística, distribución, almacenamiento, conservación de cadena de frío y aplicación de las vacunas contra la COVID-19.
e. Orientar técnicamente a los actores del Sistema General de Seguridad Social en Salud para el ingreso de datos, seguimiento y manejo del sistema de información nominal PAIWEB, así como los reportes específicos relacionados con la administración de la vacuna contra la COVID-19.
f. Realizar la implementación, seguimiento, monitoreo y evaluación de los procesos para la vacunación contra la COVID-19, así como a los indicadores del PNV por parte de los actores del Sistema General de Seguridad Social en Salud.
2. RESPONSABILIDADES DE LOS ACTORES.
Los actores que tienen a cargo el desarrollo de las actividades de vacunación contra la COVÍD-19 deberán:
2.1 ENTIDADES TERRITORIALES DEPARTAMENTALES Y DISTRITALES. <Numeral modificado por el artículo 1 de la Resolución 1703 de 2022. El nuevo texto es el siguiente:>
2.1.1. Adoptar y adaptar los lineamientos técnicos y operativos de la vacunación contra la Covid-19.
2.1.2. Verificar el cumplimiento a lo establecido en la Resolución 3100 de 2019 por parte de las IPS de su territorio, así como de la suficiencia del talento humano para garantizar la vacunación con oportunidad contra la Covid-19.
2.1.3. Contar con personal para la gestión y operación de la vacunación contra la Covid-19.
2.1.4. Participar en las reuniones de actualización y seguimiento de acuerdo con la convocatoria por parte de este Ministerio.
2.1.5. Apoyar, con su equipo de vigilancia en salud pública y a través espacios de coordinación, las actividades de vacunación contra la Covid-19, con la participación de los prestadores de servicios de salud y las entidades Responsables del aseguramiento que operen en el territorio.
2.1.6. Efectuar el seguimiento a las actividades que realicen los responsables del aseguramiento y los prestadores de servicios de salud para la vacunación contra la Covid-19 en el territorio.
2.1.7. Brindar asistencia técnica a los municipios y demás entidades responsables de la vacunación en la planeación, ejecución, seguimiento y evaluación de la vacunación en su territorio incluyendo la realizada contra la Covid-19.
2.1.8. Coordinar con instituciones responsables de la vacunación en el territorio, así como con actores aliados y demás entidades que desarrollan políticas públicas, la difusión y divulgación de la vacunación como una medida más costo efectiva para la prevención de enfermedades, incluyendo la vacuna contra la Covid-19.
2.1.9. Fortalecer los equipos de farmacovigilancia.
2.1.10. Verificar que se realice la notificación oportuna del error programático en el aplicativo VigiFlow, informar el caso al Ministerio de Salud y Protección Social, participar en las mesas técnicas que se programen, realizar seguimiento a los compromisos establecidos en las actas de mesa técnica en sus municipios e instituciones prestadoras de servicios de salud, donde se evidencien las acciones derivadas de los planes de mejora en las Instituciones vacunadoras, así como fortalecer las estrategias de capacitación y adherencia a los lineamientos del Plan Nacional de Vacunación contra la Covid-19 en su territorio, para evitar errores o eventos adversos.
2.1.11. Notificar al Ministerio de Salud y Protección Salud en la herramienta Excel de error programático y fortalecer las acciones de seguimiento, así como de fortalecimiento de capacidades descritas en el Manual Técnico y Operativo del PAI, en su capítulo 6 titulado Vacunación Segura.
2.1.12. Realizar solicitud de biológicos e insumos para la vacunación contra Covid-19 al Ministerio de Salud y Protección Social de manera periódica, garantizando un stock suficiente para cubrir las necesidades de sus instituciones prestadoras de servicios de salud y municipios.
2.1.13. Distribuir oportunamente las vacunas, diluyentes, jeringas, carné y otros insumos al interior de su territorio.
2.1.14. Realizar el seguimiento al movimiento de insumos y biológicos.
2.1.15. Amparar las vacunas e insumos para la vacunación, mediante póliza de seguro con cobertura todo riesgo, mientras estos estén bajo su custodia.
2.1.16. Consolidar de forma semanal los reportes del avance de la vacunación contra la Covid-19 según lo defina este Ministerio, con criterios de calidad de la información reportada.
2.1.17. Monitorear y evaluar los resultados del avance de la vacunación contra la Covid-19 y priorizar intervenciones tendientes a mejorar las coberturas en su territorio.
2.1.18. Garantizar la correcta custodia y almacenamiento de los biológicos e insumos.
2.1.19. Garantizar la cadena de frío según los requerimientos del fabricante y lo establecido por el Ministerio de Salud y Protección Social.
2.1.20. Garantizar el monitoreo permanente de las condiciones de almacenamiento y de transporte con instrumentos debidamente calibrados de las vacunas bajo su custodia.
2.1.21. Contar con una planta eléctrica con transferencia automática y garantizar el combustible para su funcionamiento.
2.1.22. Realizar seguimiento para el correcto uso de los bienes e insumos que sean entregados por el Gobierno nacional.
2.2 ENTIDADES TERRITORIALES MUNICIPALES.
2.2.1 Realizar el cálculo de necesidades de vacuna e insumos de la vacunación contra la COVID-19 según población objeto.
2.2.2 Garantizar la correcta custodia y almacenamiento de los biológicos e insumos.
2.2.3 Garantizar la cadena de frío de acuerdo con los requerimientos del fabricante y lo estipulado en el Manual Técnico Administrativo del Programa Ampliado de Inmunizaciones -PAI
2.2.4 Garantizar el monitoreo permanente de las condiciones de almacenamiento y de transporte con instrumentos debidamente calibrados de las vacunas bajo su custodia.
2.2.5 Garantizar técnica y financieramente el funcionamiento del sistema de información, conforme a las responsabilidades establecidas por el Ministerio.
2.2.6 Realizar seguimiento a los registros de pérdida de biológico o insumos, por manejo de la política de frascos abiertos o cualquier otra causa.
2.2.7 Realizar seguimiento para el correcto uso de los bienes e insumos que sean entregados por el Gobierno Nacional.
2.2.8 Amparar las vacunas e-insumos para la vacunación contra la COVID-19, mediante póliza de seguro con cobertura todo riesgo, mientras estos estén bajo su custodia.
2.2.9 Analizar periódicamente la productividad y el rendimiento de la vacunación de los prestadores de servicios de salud de su territorio.
2.2.10 Gestionar espacios de diálogo y concertación con los grupos étnicos de su territorio, para lograr los acuerdos y adecuaciones socioculturales para la vacunación contra la COVID-19 coordinadamente con las entidades responsables del aseguramiento e IPS.
2.2.11 Participar en las reuniones de actualización y seguimiento de acuerdo con la convocatoria por parte del Ministerio.
2.2.12 Apoyar la coordinación de las actividades de vacunación contra la COVID-19 con los prestadores de servicios de salud, entidades responsables del aseguramiento que operen en el territorio y el equipo de vigilancia en salud pública de entidades territoriales.
2.2.13 Efectuar el seguimiento a las actividades que realicen los responsables del aseguramiento y los prestadores de servicios de salud para la vacunación contra la COVID-19 en el territorio.
2.2.14 Consolidar el informe de avance de las personas vacunadas contra- la COVID-19 y enviarlo al nivel superior de forma semanal.
2.2.15 Evaluar las estrategias utilizadas para garantizar la vacunación, de la población priorizada en el Plan Nacional de Vacunación.
2.2.16 Verificar que se realice la notificación oportuna de los errores programáticos en el aplicativo VigiFlow por parte de la IPS, informar el caso a la entidad territorial Departamental, participar en las mesas técnicas que se programen para verificar el proceso de investigación, análisis y documentación del caso, realizar seguimiento a los compromisos establecidos en las actas que soportan el proceso, donde se evidencien las acciones derivadas de los planes de mejora en las Instituciones.
2.2.17 Apoyar la coordinación de las tácticas de vacunación con las comunidades étnicas presentes en la jurisdicción, teniendo en cuenta características propias de la población y territorio.
2.3. ENTIDADES RESPONSABLES DEL ASEGURAMIENTO.
2.3.1. Coordinar y articular la estrategia de vacunación con las secretarias departamentales, distritales y municipales considerando el enfoque diferencial en salud, de acuerdo con las poblaciones y sus territorios.
2.3.2. Referir a sus afiliados para la vacunación contra COVID a instituciones prestadoras de servicios de salud que realicen la vacunación contra la COVID-19.
2.3.3. Fortalecer alianzas estratégicas entre EPS y prestadores de servicios de salud para la implementación y el desarrollo de las acciones de la vacunación contra la COVID-19.
2.3.4. Participar activamente en el proceso de vigilancia, reporte, revisión y evaluación de los Eventos Adversos Posteriores a la Vacunación.
2.3.5. Garantizar la prestación integral del servicio a través de su red prestadora en caso de presentarse un Eventos Adversos Posteriores a la Vacunación.
2.3.6. Formular planes de información, educación, comunicación y difusión para su población afiliada acerca de la vacunación contra la COVID-19, cumpliendo medidas de accesibilidad y adaptabilidad, conforme a los lineamientos de este Ministerio.
2.3.7. Realizar junto con los prestadores de servicios de salud y la entidad territorial la micro planificación para la ejecución de la vacunación contra la COVID-19.
2.3.8. Garantizar que su red prestadora de servicios cuente con capacidad de respuesta y personal capacitado para el desarrollo de la vacunación contra la COVID-19.
2.3.9. Garantizar que su red prestadora de servicios de cumplimiento a la Circular No. 044 del 19 de noviembre de 2013 expedida por el Ministerio:
2.3.10. Garantizar la prestación del servicio de vacunación en el municipio y distrito de residencia de la población afiliada a través de los prestadores de servicios de salud presentes en el territorio y concertados previamente con la entidad territorial.
2.3.11 Realizar seguimiento al cumplimiento de las metas de vacunación en la población afiliada.
2.3.12. Realizar seguimiento a la información de dosis aplicadas de manera semanal.
2.3.13. Realizar proceso de seguimiento para verificar que su población asegurada tenga los esquemas completos de vacunación y realizar demanda inducida de aquellas personas que no logren contactar o no acudan a sus citas.
2.3.14. Garantizar la actualización de la información sobre la vacunación de los habitantes del territorio nacional vacunados en el extranjero, en el sistema de información nominal PAIWEB.
2.4. PRESTADORES DE SERVICIOS DE SALUD. <Numeral modificado por el artículo 1 de la Resolución 1703 de 2022. El nuevo texto es el siguiente:>
2.4.1. Realizar el cálculo de necesidades de talento humano, vacuna e insumos de la vacunación contra la Covid-19 según la meta.
2.4.2. Garantizar la contratación de los equipos vacunadores de acuerdo con la población asignada.
2.4.3. Capacitar y actualizar permanentemente al talento humano en salud encargado de la vacunación contra la Covid-19.
2.4.4. Realizar seguimiento a la aplicación del esquema completo de la vacuna contra la Covid-19.
2.4.5. Desarrollar las estrategias y tácticas de vacunación acordadas con las entidades responsables del aseguramiento que tienen a cargo actividades dentro del Plan Nacional de Vacunación y entidades territoriales, teniendo en cuenta el enfoque diferencial para grupos vulnerables y grupos étnicos y registrar en SISPRO el anexo denominado “Formulario para la actualización de los puntos de vacunación por sede de prestador”.
2.4.6. Almacenar y custodiar los biológicos cumpliendo las normas de cadena de frío.
2.4.7. Amparar mediante póliza de seguro todo riesgo las vacunas e insumos para la vacunación contra la Covid-19, mientras estos estén bajo su custodia.
2.4.8. Contar con la disponibilidad suficiente de los insumos requeridos para el proceso de vacunación contra la Covid-19.
2.4.9. Distribuir el biológico a sus vacunadores según meta día, de acuerdo con las normas de cadena de frío.
2.4.10. Garantizar los elementos de protección personal para el equipo de vacunación y de red de frío.
2.4.11. Garantizar la correcta custodia y almacenamiento de los biológicos e insumos.
2.4.12. Garantizar el monitoreo permanente de las condiciones de almacenamiento y de transporte con instrumentos debidamente calibrados de las vacunas bajo su custodia.
2.4.13. Contar con una planta eléctrica con transferencia automática y garantizar el combustible para su funcionamiento.
2.4.14. Elaborar, socializar y garantizar el protocolo y ruta de atención, al servicio de urgencias para los usuarios que así lo requieran.
2.4.15. Garantizar técnica y financieramente el funcionamiento del sistema de información, en cada uno de los niveles conforme a las responsabilidades establecidas por este Ministerio.
2.4.16. Cargar la información al aplicativo PAIWEB y consolidar la información en los formatos diseñados para la vacunación contra la Covid-19. De no ser posible realizarlo en su institución, deberá hacer las gestiones pertinentes para que la información sea cargada al aplicativo PAIWEB desde otro punto que cuente con la conectividad requerida para dicho proceso y que esta se mantenga actualizada.
2.4.17. Consolidar el informe de avance de las personas vacunadas contra la Covid-19 y enviarlo al nivel superior de forma semanal
2.4.18. Garantizar la confidencialidad de la información de los usuarios vacunados.
2.4.19. Garantizar que su red prestadora de servicios de cumplimiento a la Circular No 044 del 19 de noviembre de 2013 expedida por este Ministerio.
2.4.20. Dar cumplimiento al Plan de Gestión Integral de Residuos Hospitalarios frente al manejo de los residuos que genere el procedimiento de vacunación y actualizarlo de acuerdo con los sitios de expansión y a los residuos generados por la red de frío.
2.4.21. Realizar la facturación y envío de soportes definidos para el pago del servicio.
2.4.22. Garantizar el mantenimiento correctivo y preventivo de los equipos de red de frío.
2.4.23. Notificar al MSPS en la herramienta Excel de error programático y fortalecer las acciones de seguimiento, así como de fortalecimiento de capacidades descritas en el Manual Técnico y Operativo del PAI, en su capítulo 6 titulado Vacunación Segura.
2.4.24. Verificar que se realice la notificación oportuna del error programático en el aplicativo VigiFlow, informar el caso al departamento o distrito.
2.4.25. Realizar mesas técnicas interinstitucional con las áreas de seguridad del paciente, oficina de calidad, gestión del riesgo, talento humano, farmacovigilancia, epidemiología y PAI, la cual como resultado debe generar un acta, plan de mejora y seguimiento al usuario.
2.4.26. Realizar seguimiento a los compromisos establecidos en las actas que soportan el proceso, donde se evidencien las acciones derivadas de los planes de mejora en las Instituciones.
2.4.27. Detectar y notificar los Eventos Adversos Posteriores a la Vacunación graves y garantizar la atención integral en salud.
2.4.28. Implementar las acciones de información en salud y educación y comunicación para la salud acerca de la vacunación contra la COVID-19, cumpliendo medidas de accesibilidad y adaptabilidad, conforme a los lineamientos de este Ministerio.
2.4.29. Garantizar los apoyos y ajustes razonables para que las personas accedan según el enfoque diferencial a la vacunación sin barreras físicas, comunicacionales y actitudinales.
2.4.30. Brindar información al usuario relacionada con la vacuna, beneficios, riesgo, indicaciones, contraindicaciones, posibles eventos adversos, así como verificar si la persona comprendió la información suministrada.
2.4.31. Informar a los usuarios que la vacunación es voluntaria y diligenciar el consentimiento informado, así como salvaguardarlo.
2.4.32. Cumplir con los requisitos definidos, tanto en la modalidad intramural como en la extramural.
La población objeto de vacunación contra la COVID-19 es toda persona de 3 años y más, que habitan en el territorio nacional, incluidos los extranjeros acreditados en misiones diplomáticas o consulares en Colombia, personas que transitan en zona de frontera, a las entidades territoriales departamentales, distritales y municipales, a las entidades responsables del aseguramiento y sus operadores, a los prestadores de servicios de salud públicos y privados, incluidos los prestadores de servicios de salud indígenas, al Fondo Nacional de Salud para las Personas Privadas de la Libertad y su operador y a la Unidad Nacional para la Gestión del Riesgo de Desastres.
Los agentes del sistema general de salud deberán propender por la vacunación contra COVID- 19 de la población que reside o transita por el territorio colombiano.
5. VACUNAS CONTRA LA COVID-19.
Las vacunas contra la COVID-19 que actualmente se encuentran disponibles en el país cuentan con especificaciones técnicas e indicaciones particulares, las cuales deben ser revisadas en los anexos técnicos número 3. "Anexo técnico para la aplicación de la vacuna BNTi62b2 Pfizer- BioNTech contra la COVID-19”, en el Anexo 4. “Anexo técnico para la aplicación de la vacuna CoronaVac de Sinovac Biotech contra la COVID-19”, en el Anexo 5. Anexo técnico para la aplicación de la vacuna Oxford-AstraZeneca AZD1222 (CHADOX1-S/NCOV-19) contra la COVID-19, Anexo 6. “Anexo técnico para la aplicación de la vacuna Janssen contra la COVID- 19” y Anexo 7. “Anexo técnico para la aplicación de la vacuna de Moderna contra la COVID-19”.
6.1. ESQUEMA PRIMARIO. <Numeral modificado por el artículo 2 de la Resolución 1703 de 2022. El nuevo texto es el siguiente:>
El esquema primario está constituido por la aplicación de dos dosis o vacunas de dosis única a la población según el siguiente esquema:
Tabla 1. Esquema y biológico recomendado para vacunación contra la Covid-19
| Edad recomendada de aplicación | Biológico recomendado |
| 3 a 5 años | Sinovac Life Scienses Co Ltd denominada CoronaVac |
| 6 a 11 años | Sinovac Life Scienses Co Ltd denominada CoronaVac |
| Moderna ARNm-1273, Switzerland GmbH* | |
| 12 a 17 años | Pfizer Inc y BioNTech |
| Moderna ARNm-1273, Switzerland GmbH | |
| Sinovac Life Scienses Co Ltd denominada CoronaVac | |
| 18 años y más | Sinovac Life Scienses Co Ltd denominada CoronaVac |
| Pfizer Inc y BioNTech | |
| Moderna ARNm-1273, Switzerland GmbH | |
| ChAdOx1-S* recombinante o AZD1222 del laboratorio AstraZeneca | |
| Janssen Pharmaceutica NV | |
* La administración de vacuna Moderna ARNm-1273, Switzerland GmbH, en niños de 6 a 11 años se realizará en una serie de 2 (dos) dosis de 50 microgramos (0,25 ml cada una) con un intervalo de 28 días después de la primera dosis.
Las personas de 12 años o más, a partir de los 4 meses de haber completado el esquema primario podrán acceder a las dosis de refuerzo.
6.2.1.1. La población de 18 años o más accederá al refuerzo de acuerdo con la siguiente tabla:
Tabla 2. Esquemas y biológico recomendado para vacunación de refuerzo contra la COVID-19
| Esquema primario | Dosis de refuerzo | Plataforma |
| ARNm (Pfizer) | Homologa | |
| ARNm (Pfizer) | ARNm Moderna | Heteróloga |
| Vector viral (AstraZeneca y Janssen) | ||
| ARNm Moderna | Homologa | |
| ARNm (Moderna) | ARNm (Pfizer) | Heteróloga |
| Vector viral (AstraZeneca y Janssen) | ||
| Vector Viral (AstraZeneca) | Homologa | |
| Vector Viral (AstraZeneca) | ARNm (Pfizer - Moderna) | Heteróloga |
| Vector viral (Janssen) | ||
| Vector Viral (Janssen) | Homologa | |
| Vector Viral (Janssen) | ARNm (Pfizer - Moderna) | Heteróloga |
| Vector Viral (AstraZeneca) | ||
| ARNm (Pfizer - Moderna) | Heteróloga | |
| Virus Inactivado (Sinovac) | Vector Viral (AstraZeneca - Janssen) | |
| Virus Inactivado (Sinovac) | Homologa | |
6.2.1.2. Las personas de 12 a 17 años solamente podrán recibir dosis de refuerzo con el biológico de ARNm Pfizer.
6.2.2. SEGUNDO REFUERZO. <Numeral modificado por el artículo 3 de la Resolución 1703 de 2022. El nuevo texto es el siguiente:>
Las personas mayores de 18 años podrán recibir una segunda dosis de refuerzo de vacuna contra la Covid-19, la cual deberá ser aplicada a partir del cuarto mes posterior a la aplicación del primer refuerzo.
Las vacunas que deberán ser usadas para este segundo refuerzo son las de plataforma ARN mensajero (Pfizer o Moderna). Cuando el segundo refuerzo se realice con vacuna del laboratorio Moderna, se deberá usar la mitad de la dosis, equivalente a 50 microgramos (0.25 ml); sin embargo, podrán recibir la dosis de otro biológico si el médico así lo recomienda, siempre y cuando esté disponible y autorizado en el país.
Las personas que habitan en el territorio o que se encuentren en tránsito independiente del documento de identificación con el que cuente, con o sin afiliación al Sistema General de Seguridad Social en Salud pueden acceder a cualquier punto de vacunación sin agendamiento previo en todo el territorio nacional para iniciar, continuar o completar el esquema de vacunación contra la COVID-19.
Las entidades promotoras de salud, las entidades administradoras de los regímenes Especial y de Excepción y el Fondo Nacional de Salud de las Personas Privadas de la Libertad deben realizar el seguimiento de todos los usuarios a su cargo implementando las estrategias de demanda inducida que disponga sean llamadas telefónicas, mensajes de texto, mensajería instantánea, correo electrónico, medios de comunicación, entre otros, con el fin de captar la población susceptible en los diferentes grupos de edad pendientes por iniciar, continuar o completar sus esquemas de vacunación.
Si el esquema de vacunación requiere de dos dosis y refuerzos se agendará una fecha en el carné de vacunación físico respetando el intervalo entre las dosis y los esquemas de vacunación aprobados por este Ministerio.
7.1. ACTIVIDADES PREVIAS DEL PROCESO DE VACUNACIÓN.
Los prestadores de servicios de salud deberán realizar fas siguientes actividades de información al usuario:
--Como acceder a los servicios de vacunación para iniciar, continuar o completar su esquema de vacunación.
--La vacunación es voluntaria y, por tanto, deberá manifestar si desea vacunarse.
--Indicar a la persona que no pierde su derecho a vacunarse hasta cuando manifieste libre y autónomamente su voluntad de acceder al procedimiento.
--Informar sobre las contraindicaciones particulares para su aplicación contenidas en el anexo técnico de cada una de las vacunas.
--Como acceder al formato de consentimiento informado, publicado en plataforma MIVACUNA COVID-19 si desea hacerlo, de lo contrario se le entregará en el momento previo a la vacunación.
7.2. APLICACIÓN Y REGISTRO DE LA VACUNA.
Las personas podrán acercarse a las instituciones prestadoras de servicios de salud que tengan habilitados servicios de vacunación de acuerdo con lo establecido la Resolución 3100 de 2019 o la norma que la modifique o sustituya. Los menores de edad y quienes hayan sido declarados incapaces por sentencia judicial comparecerán en los términos de la Ley 1996 de 2019.
Durante el tiempo que permanezca la persona en el procedimiento de vacunación, el prestador de servicios de salud deberá desarrollar actividades de comunicación e información en salud, en caso de presentarse una reacción adversa grave al momento de la vacunación, iniciará el protocolo de atención y activará el sistema de referencia y contrarreferencia en el caso de requerirlo.
Las personas que asistan para aplicar la segunda dosis de la vacuna, o dosis de refuerzo en un lugar diferente a aquel en el que recibieron su primera dosis o su esquema primario, incluso si esta fue aplicada en otro país, podrán ser vacunadas y registradas, si el prestador cuenta con una vacuna del laboratorio indicado según lo establecido en el numeral 6 de la presente Resolución.
7.2.1. CONSENTIMIENTO INFORMADO PARA LA VACUNACIÓN CONTRA LA COVID-19.
El consentimiento informado es un procedimiento que hace parte del proceso de vacunación contra la COVID-19, mediante el cual el usuario del servicio manifiesta de manera autónoma su voluntad de recibir o no el esquema de vacunación, previa entrega de la información respecto a la vacuna, la relación riesgo - beneficio, las indicaciones, contraindicaciones y los posibles eventos adversos esperados de la vacuna que se le va a aplicar y atender cualquier inquietud que tenga al respecto.
Se debe diligenciar el formato de consentimiento informado, adoptado en el Anexo 2 “consentimiento informado para la aplicación de la vacuna contra el SARS-CoV-2/COVID-19” de la presente resolución.
Si la persona se presenta con el formato del consentimiento informado, diligenciado, se le deberá suministrar la información sobre beneficios y riesgos, confirmar si la comprendió y en caso afirmativo, aplicar la vacuna. Si no lo lleva impreso, el prestador de servicios de salud deberá entregar el formato, suministrar la información sobre beneficios y riesgos, indicar que la vacunación es voluntaria y preguntar si acepta vacunarse. Si la respuesta es negativa se dejará el registro en el mismo formato y en el PAIWEB, indicándole a la persona que no pierde su derecho de vacunarse cuando manifieste libre y autónomamente su voluntad en ese sentido y se le señalará que para estos efectos podrá solicitar al prestador de servicios de salud la aplicación de -la vacuna.
Las entidades responsables del aseguramiento en salud y el prestador de servicios de salud deberán garantizar el enfoque diferencial de acuerdo con los contextos interculturales para facilitar el diálogo y la comunicación con mensajes claros y sencillos, y la adecuación necesaria, así como la disponibilidad de intérprete para disminuir el temor, aclarar inquietudes y generar confianza hacia la vacunación.
Este documento se debe salvaguardar en la historia clínica del paciente.
El prestador de servicios de salud registrará en el carné de vacunación establecido para tal fin la aplicación de la vacuna. En él se deben diligenciar todas las variables de manera completa, clara y legible. De igual manera reiterar al usuario la importancia de la conservación de este documento.
8. ESTRATEGIAS Y TÁCTICAS DE VACUNACIÓN.
Las estrategias y tácticas de vacunación a implementarse en cada entidad territorial deben tener en cuenta las características económicas, sociales, demográficas, culturales y geográficas de cada territorio o micro territorio, así como la aceptabilidad de las vacunas en la población, población objeto, disponibilidad de insumos y biológicos, entidades responsables del aseguramiento, prestadores de servicio de salud, entre otros; por lo que se debe contar con un panorama general y de esta manera establecer una adecuada microplanificación, fundamental para la toma de decisiones. Se precisa que las estrategias y tácticas de vacunación deben ser evaluadas y ajustadas permanentemente, para que respondan a las necesidades cambiantes de la población sujeto de la intervención.
8.1 ESTRATEGIAS DE VACUNACIÓN. <Numeral modificado por el artículo 4 de la Resolución 1703 de 2022. El nuevo texto es el siguiente:>
Dando cumplimiento a lo establecido en la Resolución 3100 de 2019, la vacunación se realiza a través de las modalidades intramural o extramural como parte de las acciones de salud pública para lograr la protección de la población y según los estándares establecidos para la prestación del servicio. En la medida en que progresivamente se da cumplimiento a la vacunación en la población sujeto, se deben ir evaluando los avances y las tácticas establecidas e ir incorporando nuevas cuando las anteriores ya disminuyan su productividad, incluso el operar varias tácticas al tiempo puede agilizar los procesos de vacunación, siempre y cuando se realice evaluación periódica de las mismas.
La estrategia de vacunación se define entre los prestadores de servicios de salud y las entidades promotoras de salud, las entidades adaptadas, los administradores de los regímenes Especial y de Excepción en salud, el Fondo Nacional de Salud de las personas privadas de la libertad y los departamentos y distritos en los espacios de coordinación territorial, debiendo diligenciar el prestador de servicios de salud el “Formulario para la actualización de los puntos de vacunación por sede de prestador” en la Plataforma SISPRO y la entidad territorial un acta o registro de control del desarrollo de dichas mesas.
Debe desarrollarse de manera conjunta entre las entidades territoriales, las entidades responsables de aseguramiento y las instituciones prestadoras de servicios de salud, con el fin de definir las estrategias y tácticas de vacunación en cada uno de los niveles territoriales, a través de la elaboración de un plan de trabajo, identificando la población y prestadores de servicios de salud encargados de aplicar la vacuna contra la COVID-19. Para tal efecto se deberá:
a. Identificar las estrategias y tácticas locales de vacunación con base en las características territoriales, esto es puestos fijos, puestos móviles, ampliación de horarios de vacunación (vespertinos, nocturnos y días no hábiles como sábados, domingos y festivos).
b. Determinar el número de equipos de vacunación requeridos de acuerdo con las estrategias y tácticas.
c. Formular el plan de trabajo
d. Es importante tener en cuenta las indicaciones de la Resolución 3280 del 2018 para adecuaciones socioculturales de grupos étnicos para las intervenciones en salud, tales como calendarios ecológicos, ceremonias y rituales, entre otros.
9.1 ESTIMACIÓN DE NECESIDADES DE VACUNA, JERINGAS E INSUMOS.
Con el fin de garantizar la oferta permanente de vacunas contra el COVID-19, las entidades territoriales y las instituciones prestadoras de servicios de salud, deberán programar un número suficiente de vacunas que permitan atender la demanda de sus poblaciones. Determinarán la capacidad de almacenamiento, la existencia y necesidades de equipos para almacenamiento y transporte de vacuna (cajas y termos precalificados), refrigeradores precalificados, sistema de monitoreo, contenedores de paredes rígidas para el descarte de material cortopunzante y demás insumos y calcular las necesidades de vacuna, jeringas, insumos, en función de las dosis a aplicar en la vacunación según la población sujeto, procurando siempre disminuir el riesgo de pérdidas.
Una vez definidas las necesidades a nivel territorial, municipal o de las insIPS, se deberán solicitar periódicamente las vacunas contra la COVID-19 según el análisis de la población susceptible en el territorio y la capacidad de almacenamiento. Así mismo, se debe garantizar una reserva que permita abastecer oportunamente a los municipios y sus IPS para garantizar la vacunación de la población.
Para el cálculo de necesidades se deberán tener en cuenta como mínimo las siguientes variables:
A. Población objeto según DAÑE de 3 años y más
B. Total de personas que recibieron primeras dosis o dosis única
C. Total de personas susceptibles para primeras dosis o únicas (A-B)
D. Total de personas que recibieron segundas dosis o dosis únicas
E. Personas Susceptibles de segundas dosis (C-D)
F. Total de personas con primer refuerzo.
G. Total de personas pendientes de Primer Refuerzo (D-F)
H. Personas mayores de 50 años que ya cuentan con su primer refuerzo.
I. Personas que recibieron segundo refuerzo
J. Personas Susceptibles de Segundo Refuerzo (H-l)
Teniendo en cuentas las diferentes plataformas y las indicaciones de cada una de ellas se deberá realizar cálculo de necesidades por grupos específicos atendiendo lo señalado en el numeral 6 del presente anexo.
9.2. SOLICITUD DE VACUNAS, JERINGAS E INSUMOS.
De acuerdo con la evaluación de necesidades y las capacidades de almacenamiento, las entidades territoriales deberán realizar solicitudes de vacunas e insumos de manera periódica. Las solicitudes deben atender a la necesidad y garantizar una reserva de al menos 20 días para garantizar la atención de solicitudes de las instituciones prestadoras de servicios de salud y municipios de su jurisdicción.
La solicitud se realizará mediante oficio radicado al Ministerio de Salud y Protección Social firmado por el secretario departamental o distrital de salud o quien haga sus veces y deberá detallar la necesidad de vacunas por fabricante.
Para la asignación de vacunas, el Ministerio realizará la evaluación de necesidades de las entidades territoriales del orden departamental y distrital y podrá asignar cantidades superiores a las solicitadas en atención a la evaluación de saldos en las entidades territoriales, población susceptible, así como de la velocidad y el ritmo de vacunación reportado.
9.4. TRASLADOS DE VACUNA, JERINGAS E INSUMOS.
Las entidades territoriales del orden departamental, distrital y municipal de acuerdo con sus inventarios y necesidades podrán realizar traslados de vacunas a otros municipios, distritos o departamentos, para lo cual y de acuerdo con las condiciones de transporte podrán solicitar acompañamiento del Ministerio de Salud y Protección Social.
El procedimiento para realizar traslados entre entidades territoriales del orden municipal deberá ser informada y coordinada por la secretaria departamental o quien haga sus veces.
Los traslados entre entidades del orden departamental y distrital deberán ser informadas al Ministerio de Salud y Protección Social mediante oficio radicado y en el cual se deberán detallar las cantidades, nombre de fabricante y lote de las vacunas o insumos a trasladar. También se deberá detallar la necesidad o no de acompañamiento para conservar la temperatura de las vacunas.
La vacunación segura, incluye diferentes elementos, desde la producción y el control de la calidad de la vacuna, la evaluación y garantía de la eficacia y seguridad, el transporte y distribución, la implementación de prácticas adecuadas de aplicación y el uso del biológico hasta la disposición de los residuos generados del proceso.
Se deben tener todas las precauciones y acciones tendientes a conservar la seguridad del vacunado, el vacunador y el medio ambiente, por ejemplo, aplicar las normas de bioseguridad, uso de los correctos en vacunación, manejo de residuos en la vacunación intra y extramural, entre otros, descritas en el capítulo de vacunación segura del Manual Técnico Administrativo del PAI, Tomo 6 Capítulo 17.
10.1 INSTRUCCIONES PARA LA ADMINISTRACIÓN, USO Y MANEJO DE LA VACUNA.
La respuesta a una vacunación contra la COVID-19, implica que las autoridades sanitarias garanticen la capacidad requerida para recolectar con seguridad las jeringas y agujas, transportarlos a los sitios designados y dar la disposición final adecuadamente. En ese orden, las principales actividades a desarrollar y monitorear para garantizar una inyección segura son:
a. Implementar los lineamientos de inyección segura en los tres aspectos: vacunado, personal de salud y medio ambiente, según los "Lineamientos Generales para PAI en el contexto de la pandemia COVID-19, Colombia 2021-GIPG15” (https://www.minsalud.gov.co/Ministerio/lnstitucional/Procesos%20y%20procedimientos/GIPS15.pdf).
b. Disponer en el punto de vacunación de los elementos, equipos, insumos y personal requerido, durante el alistamiento, preparación y aplicación del biológico con el fin de fortalecer la confianza y aceptación de esta.
c. Verificar las características del vial y en caso de identificar decoloración, partículas, ausencia, deterioro o falta de visibilidad de la etiqueta, realizar la notificación conforme lo dispuesto en los anexos técnicos de los biológicos, que hacen parte de esta resolución.
d. Verificar antes de la administración de inmunobiológicos los correctos entre ellos: usuario, vacuna, dosis, edad, vía, jeringa y aguja, fecha de vencimiento, intervalo, sitio anatómico, esquema, indicaciones, entre otras.
e. Explicar en forma clara y sencilla el procedimiento a realizar.
f. Verificar el antecedente vacunal.
g. Realizar el lavado de manos con agua y jabón o higiene de manos con alcohol glicerinado o gel antibacterial.
h. Aplicar las normas de bioseguridad y técnica aséptica durante la preparación y administración de la vacuna.
i. Preparar el equipo necesario para la administración de la vacuna.
j. Usar la jeringa correcta de acuerdo con la vía de aplicación de la vacuna.
k. Antes de la dilución, la vacuna debe presentarse como una solución blanquecina sin partículas visibles.
l. Desechar la vacuna si hay partículas o decoloración, teniendo en cuenta el PGIRHS.
m. Envasar la dosis correcta en la jeringa según la edad del vacunado.
n. Elegir el sitio anatómico de la aplicación, se sugiere aplicar en el brazo izquierdo, verificando que la piel y los tejidos se encuentren sanos.
o. Evitar movimientos bruscos durante la vacunación.
p. Estabilizar la extremidad de la persona para la aplicación de la vacuna:
q. Limpiar el sitio anatómico a inyectar: solo lo visiblemente sucio, para ello se debe utilizar una torunda de algodón previamente seca, humedecida en agua limpia, con movimientos centrífugos, del centro a la periferia, en una sola pasada.
r. No realizar masajes, ni hacer presión en el sitio de la aplicación.
s. Aplicar las normas técnicas en el manejo de los residuos según la normatividad vigente.
t. Limpiar suavemente el sitio de la vacunación si hay sangrado.
u. Explicar a los usuarios o cuidadores, que en el sitio de aplicación de la vacuna no se le debe realizar masajes, ni colocar compresas, curas o administrar medicamentos.
v. Explicar los posibles eventos secundarios seguidos a la vacunación.
w. Realizar monitoreo de los eventos adversos posteriores a la vacunación.
x. Control y rotar el inventario de las vacunas contra la COVID-19 según la fecha de vencimiento.
y. Asegurar la capacitación permanente del talento humano que genere capacidades y habilidades para interactuar en contexto con población étnica y el enfoque diferencial, haciendo énfasis en la humanización en la atención, el buen trato y la no discriminación.
Conforme al conocimiento actual de la enfermedad causada por la COVID-19 y de sus mecanismos de transmisión, en aras tanto de la seguridad del trabajador de la salud como del usuario, se insta a todas las instituciones a seguir medidas de bioseguridad en todo momento en las modalidades intramural y extramural según la habilitación del servicio de acuerdo con los "Lineamientos generales para el programa ampliado de inmunizaciones (PAI) en el contexto de la pandemia de COVID-19. Colombia 2021-GIPG15"
https://www.minsalud.gov.co/Ministerio/institucional/Procesos%20y%20procedimientos/GIPS15.pdf
En ese sentido la institución debe proveer los Elementos de Protección Personal (EPP) como mínimo tapabocas y guantes sólo en los casos establecidos en el lineamiento general del PAI y garantizar el suministro de jabón, toallas desechadles, material de limpieza y desinfección, y demás que se requieran para disminuir el riesgo de trasmisión de enfermedades respiratorias, incluyendo la COVID- 19. Además, contar con los apoyos y ajustes razonables para que las personas con discapacidad accedan sin barreras físicas, comunicativas y actitudinales a la vacunación.
La institución debe establecer una ruta de acceso de atención en el servicio de vacunación para la identificación de personas sintomáticas respiratorias y de esta manera tomar las respectivas medidas preventivas y canalización según sea el caso.
Adicionalmente verificará la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante, si es así se deberá:
--Reportar al coordinador del punto de vacunación su hallazgo.
--No utilizar el vial, separarlo y marcarlo como cuarentena.
--Realizar un video del vial, evidenciando su hallazgo.
--Realizar el reporte al coordinador municipal o distrital, por correo electrónico indicando lote y fabricante y adjuntar la evidencia.
--Reportar al nivel municipal y de éste al nivel departamental o distrital, según sea el caso.
--El nivel departamental o distrital informará a este Ministerio a través del canal establecido por el PAI y este informará al Invima y a la entidad que corresponda según el mecanismo de adquisición de la vacuna.
11. ADMINISTRACIÓN EN PERSONAS CON SITUACIONES ESPECIALES.
No existen contraindicaciones para vacunar personas con:
a. Comorbilidades: obesidad, diabetes mellitus, enfermedad renal crónica, EPOC, falla cardiaca, hipertensión arterial, hipotiroidismo, enfermedades reumáticas o hematológicas.
b. Cáncer activo en tratamiento.
c. Enfermedad oncológica avanzada y patologías hematológicas neoplásicas y benignas asociadas a inmunosupresión, incluyendo, pero- no limitado a leucemias agudas, crónicas linterna, mieloma y aplasia medular.
d. Enfermedad oncológica en quienes se planea iniciar tratamiento o quienes acaban de terminarlo (<6 meses).
e. Trasplante de progenitores hematopoyéticos u órganos sólidos o en lista de espera para trasplante.
f. Infección por VIH independiente del número de CD4.
g. Tuberculosis latente, activa o fibrotórax.
h. Tratamiento con dosis altas de esferoides (0.5 mg/kg/día por más de 10 días), uso de DMARD o inmunomoduladores.
i. Inmunodeficiencias primarias u otro tipo de inmunosupresión incluyendo esplenectomizados o con asplenia funcional.
j. Esclerosis múltiple y neuromielitis óptica.
k. Antecedentes de síndrome de Guilfain Barré o parálisis facial (parálisis de Bell).
L Trastornos de coagulación o anticoagulados.
11.1. CONSIDERACIONES ANTES DE ADMINISTRAR LA VACUNA EN PACIENTES CON CÁNCER O INMUNOSUPRESIÓN:
a. Para los pacientes con neoplasias en tratamiento activo se recomienda aplicar la vacuna entre ciclos de terapia y después de períodos de espera, idealmente se debería programar la fecha de vacunación según el concepto del médico tratante. La imposibilidad de obtener dicho concepto no debe contraindicar la vacunación en ninguna circunstancia.
b. En pacientes inmunosuprimidos la protección que provee la vacuna contra SARS-CoV-2, al igual que otras vacunas puede estar comprometida. Por lo tanto, frente a los que han recibido tratamientos que producen depleción de células B (uso de globulina antitimocito, rituximab, obinutuzumab) se debe posponer de 3 a 6 meses la vacunación, en analogía con otras vacunas.
Los pacientes con trastorno de la coagulación o que están anticoagulados no tienen contraindicación alguna para la vacunación; sin embargo, deben tenerse en cuenta las siguientes consideraciones:
a. Se debe usar la aguja más pequeña disponible (23-25G de 5/8”).
b. Se debe aplicar presión sobre la zona al menos por 10 minutos después de la inyección y se debe instruir al paciente a vigilar la aparición tardía de hematomas (2-4 horas después).
c. Para pacientes con niveles de factor VIII o IX mayores a 10% no se requieren medidas hemostáticas particulares.
d. Para pacientes con hemofilia severa o moderada, sería ideal la aplicación de factor VIII o IX antes de la vacunación para disminuir el riesgo de hematomas, en especial si el paciente está en profilaxis primaria o secundaria; esto debe ser ajustado dependiendo del tipo de factor y el esquema de tratamiento que el paciente recibe.
e. En los casos en que no haya disponibilidad de factor, se deben intensificar las medidas hemostáticas locales, pero no posponer la vacunación.
f. Los pacientes en tratamiento con Emicizumab (tengan o no inhibidores) pueden ser vacunados en cualquier momento sin precauciones hemostáticas ni dosis de factor VIII adicional.
g. En los pacientes con Enfermedad de Von Willebrand, ya que el espectro de presentación es muy variable, la decisión sobre medidas hemostáticas previas a la vacuna, deben ser decididas en conjunto con el médico tratante en forma individualizada, no obstante, ante la imposibilidad de contactarlo no debe posponerse la vacunación, maximizando las medidas hemostáticas locales.
h. Los pacientes que están recibiendo warfarina deberán tomarse un INR 72 horas antes de la vacunación. Si este está en rango terapéutico estable podrán ser vacunados intramuscularmente. No es necesario suspender la anticoagulación ni esquemas "puente" con heparinas de bajo peso molecular.
i. Los pacientes que hayan recibido transfusión de sangre o derivados deben recibir la vacuna mínimo 4 semanas después del procedimiento.
Mediante la Resolución 2021027977 del 9 de Julio de 2021 el INVIMA resolvió actualizar la Resolución 2021000183 del 5 de enero del 2021, mediante la cual se concedió la Autorización de Uso de Emergencia No ASUE 2021-000001 para la vacuna Pfizer-BioNTech COVID-19 Vaccine a favor de PFIZER Inc., por el término de un año, incluyendo en las precauciones y advertencias que se puede considerar su administración en mujeres gestantes desde la semana doce (12) y las mujeres durante los 40 días postparto, “si los posibles beneficios superan los posibles riesgos con base en la evaluación clínica realizada en conjunto por el médico tratante y la gestante” (Énfasis fuera del texto)
Ahora bien, el único requisito que se debe exigir para la aplicación de la vacuna de Pfizer-BioNTech en mujeres embarazadas, es la suscripción del consentimiento informado en donde manifieste que realizó previamente la evaluación riesgo - beneficio junto con su médico tratante.
A la fecha, el uso en mujeres gestantes, de los demás biológicos que tienen Autorización Sanitaria de Uso de Emergencia, no reporta evidencia suficiente para establecer el balance riesgo - beneficio, por lo tanto, solo se podrá aplicar la vacuna de Pfizer-BioNTech COVID-19 a esta población.
Adicionalmente, el Ministerio de Salud y Protección Social, con el acompañamiento de la Federación Colombiana de Obstetricia y Ginecología FECOLSOG, evaluó en detalle los elementos y recomendaciones frente al riesgo beneficio de la vacunación en gestantes para prevenir la infección por SARS-CoV-2/COVID-19 y analizó la situación de la vacunación que se ha presentado en mujeres que desconocían su condición clínica de estado de embarazo al recibir un biológico que no tiene autorización actual para esta población y se consensuó priorizar y aplicar el biológico autorizado del Laboratorio farmacéutico de Pfizer-BioNTech a las gestantes para la vacunación, en los siguientes términos:
--Dado que el embarazo se considera factor independiente de riesgo para enfermedad grave o muerte por COVID-19, la adolescencia no debe ser una limitante para acceder a la vacunación de gestantes, siempre y cuando las indicaciones del biológico lo permitan.
--No debe restringirse el acceso a la vacunación en las pacientes con fetos malformados o aquellas que soliciten acceder a interrupción voluntaria del embarazo.
--La segunda dosis del biológico deberá administrase en el tiempo establecido, incluso si ha pasado el día 40 posparto.
--La segunda dosis deberá aplicarse con el biológico autorizado y en los tiempos recomendados, esto es 21 días desde la primera dosis.
--En el caso de anafilaxia, no se deberá recibir una segunda dosis del biológico.
--Ante la presencia de las categorías de efectos vaso-vagales o secundarios locales y sistémicos, se administrará la segunda dosis del biológico autorizado.
--Las mujeres gestantes desde la semana doce (12) y las que se encuentren dentro de los 40 días postparto, pueden accederá la vacunación con el biológico de PFIZER-BioNTech, independientemente de su condición migratoria. La aplicación se reportará en PAIWEB, sin que se requiera un registro previo de identificación.
--Aplicar la segunda dosis en mujeres gestantes a partir de las 12 semanas y hasta los 40 dios postparto que tuvieron una primera dosis inadvertida de un biológico que no estaba autorizado para este grupo, esto es, AstraZeneca, Moderna o Sinovac, completando el esquema con el biológico autorizado.
Coadministración de la vacuna contra Covid-19 y otros biológicos durante la gestación:
El Centro para el Control y la Prevención de Enfermedades (CDC) de Atlanta, en su publicación "Consideraciones clínicas provisionales para el uso de vacunas COVID-19 actualmente autorizadas en los Estados Unidos”, en relación con la coadministración con otros biológicos, refiere que la vacuna contra el COVID - 19 y otras vacunas se pueden administrar el mismo día, así como con cualquier intervalo, sin necesidad de guardaran tiempo mínimo entre una vacuna y otra. Lo anterior aplica, como lo indica el texto citado, solo para las vacunas contra el COVID -19 autorizadas por la EDA en los E.E.U.U (Pfizer-BioNTech, Moderna y Janssen).
Si se va a administrar la vacuna contra el COVID - 19 de los laboratorios Pfizer-BioNTech, Moderna y Janssen y la vacuna contra influenza en una sola visita, el sitio anatómico de aplicación debe ser diferente, la vacuna contra el COVID - 19 se aplica en el brazo izquierdo y la vacuna contra influenza estacional en el brazo derecho. En caso de requerirse aplicar la vacuna en el mismo brazo, para adolescentes y adultos, el músculo deltoides puede usarse para más de una inyección intramuscular, procurando guardar una distancia de mínimo 2 centímetros entre inyección.
Para las demás vacunas contra el COVID - 19 de los laboratorios Sinovac y AstraZeneca, disponibles en Colombia, no existe aún suficiente evidencia científica que permita la coadministración con otros biológicos, por lo tanto, las personas que reciban vacuna contra COVID - 19 de uno de los laboratorios mencionados, deberá conservar un periodo mínimo 14 días antes o después de la administración de cualquier otra vacuna. En la medida en que avancen los estudios relacionados con estas vacunas, se actualizarán las indicaciones técnicas relacionadas con la aplicación simultánea con otras vacunas.
En el caso de la aplicación de la Inmunoglobulina anti-D para prevención de enfermedad Rh, no debe verse alterada por la vacunación y podría ser administrada incluso en el mismo momento si llegara a ser necesario pues este no afecta la respuesta inmune que genera la vacuna.
11.4 VACUNACIÓN EN PERSONAS CON ANTECEDENTES DE LA COVID-19 CONFIRMADO.
Las personas que han presentado COVID-19 deben completar el esquema primario y colocar la dosis de refuerzo, ninguna dosis debe ser retrasada. Adicionalmente, tener en cuenta que para su aplicación deben pasar treinta (30) días contados desde la fecha de inicio de síntomas en personas sintomáticas o treinta (30) días contados desde la toma de muestra de personas asintomáticas.
Las personas con inmunosupresión de cualquier origen, ya sea por enfermedad o como tratamiento de alguna condición y con antecedente de COVID-19 podrán ser vacunados treinta (30) días después de la fecha de inicio de síntomas o de la toma de muestra en caso de ser asintomática.
12. MANEJO DE RESIDUOS GENERADOS EN LA ACTIVIDAD DE VACUNACIÓN.
Se debe tener en cuenta lo establecido en el Titulo 10 de la Parte 8 Libro 2 del Decreto 780 de 2016 para la gestión integral de los residuos generados en la atención de salud y otras actividades y el Manual de Procedimientos para la Gestión Integral de los Residuos Hospitalarios y Similares adoptado mediante la Resolución 1164 de 2002, para el manejo de residuos generados en la actividad de vacunación teniendo en cuenta los siguientes aspectos:
a. Evaluar la capacidad instalada y realizar el alistamiento de todas las actividades asociadas a la gestión de los residuos, que con motivo de la logística y las jornadas de vacunación de COVID-19 se puedan generar.
b. Revisar y ajustar los planes de gestión de residuos generados en la atención en salud de los prestadores de servicios de salud y de las actividades de salud pública a cargo de las autoridades sanitarias, involucrando la gestión de los residuos producto de la vacunación intramural y extramural y actividades asociadas.
c. Hacer el alistamiento de los insumos, equipos y elementos para el correcto manejo, segregación de los residuos generados en el proceso de vacunación y fas demás actividades establecidas en la gestión de estos según el marco normativo.
d. Capacitar al personal de salud y de apoyo en el manejo seguro y gestión de los residuos, teniendo en cuenta los principios de bioseguridad, precaución, prevención y comunicación del riesgo establecidos en el Decreto 780 de 2016.
e. Coordinar con los gestores de residuos la disposición final de estos, de acuerdo con las tecnologías y tratamientos disponibles en las diferentes zonas del país, según las orientaciones, las licencias y autorizaciones expedidas por las autoridades ambientales competentes.
f. Cumplir con las normas universales de bioseguridad y las de seguridad y salud en el trabajo, g. Las jeringas auto descartables se clasifican como residuos cortopunzantes, por lo cual deben disponerse en contenedores rígidos conforme a la normatividad vigente.
h. Los frascos usados o abiertos o que contengan restos de la vacuna deben ser desechados en contenedores rígidos, porque son residuos peligrosos cortopunzantes y luego para la entrega al gestor se debe entregar en bolsa, de acuerdo con lo previsto en el artículo 2.8.10.5 Decreto 780 de 2016.
i. Los elementos o insumes utilizados y descartados durante la ejecución de la actividad de vacunación que tienen contacto con fluidos corporales de alto riesgo (sangre), tales como: gasas, apósitos, aplicadores, algodones, guantes, entre otros, se clasificarán como residuos peligrosos de riesgo biológico o infeccioso, biosanitarios, los cuales deben ser segregados en bolsa y contenedor de color rojo rotulada de acuerdo con la normatividad vigente.
j. El empaque de la jeringa y el capuchón de la aguja siempre y cuando no se encuentran contaminados de sangre o fluidos se segregaran como residuos no peligrosos aprovechables en bolsa de color blanco o gris conforme a la Resolución 2184 de 2019 modificada por la Resolución 1344 de 2020 del Ministerio de Ambiente y Desarrollo Sostenible y la Resolución 1164 de 2002 del Ministerio de Salud y Ministerio del Medio Ambiente.
12.1 VIGILANCIA SANITARIA Y COORDINACIÓN INTERSECTORIAL.
Se insta a las autoridades sanitarias y a las demás competentes a realizar las acciones de vigilancia sanitaria de la gestión interna de los residuos en el marco de sus competencias y realizar la coordinación intersectorial con las autoridades territoriales y ambientales en el marco de la gestión integral de los residuos para garantizar la prevención de los riesgos sanitarios e impactos ambientales asociados a estas actividades.
13.1. SISTEMA DE INFORMACIÓN NOMINAL PAIWEB.
La gestión de la información correspondiente a la vacunación contra la COVID-19 se realizará de manera obligatoria de dos maneras: i) sistema de información nominal PAIWEB, y ii) reporte cuantitativo de dosis aplicadas. Tanto el PAIWEB como el reporte cuantitativo será realizado por parte de los prestadores de servicios de salud y las entidades territoriales, actores que garantizarán la calidad de la información.
Se realizará el registro de la aplicación del biológico tanto en registro diario como en el PAIWEB y al final de la jornada diaria se realizará un conteo de dosis aplicadas según los grupos de edad, con el fin de realizar el reporte cuantitativo.
Las entidades que participen en el flujo y consolidación de la información serán responsables del cumplimiento del régimen de protección de datos, en virtud de lo cual se hacen responsables de la privacidad, seguridad, confidencialidad y veracidad de la. información suministrada y sobre los datos a los cuales tienen acceso.
13.2. GESTIÓN POR MÓDULO EN EL SISTEMA PAIWEB.
El sistema de información del PAIWEB contará con los manuales de uso y de tutoriales los cuales están dispuestos en la página web de este Ministerio para su consulta.
13.3. REGISTRO CUANTITATIVO DE DOSIS APLICADAS.
El registro diario de vacunación como fuente primaria de información será socializado a las entidades territoriales y a los prestadores de servicio de salud. Se realizarán capacitaciones sobre el correcto diligenciamiento y utilidades de este, el cual, al mejorar la calidad al momento de realizar la captura del dato, permitirá generar los reportes que se requieran con mayor eficiencia.
De manera complementaria se dispondrá de herramientas comunicativas de capacitación, que serán distribuidas tanto a las entidades territoriales como a los prestadores de servicio de salud.
13.4. GESTIÓN DEL COMPONENTE TECNOLÓGICO.
Teniendo en cuenta que la información de la población vacunada en jornadas, puntos móviles y vacunación casa a casa, debe ingresarse en tiempo real se debe disponer de equipos de cómputo exclusivos y suficientes, que cumplan con las especificaciones para el manejo del sistema de información nominal del PAI, con una línea de acceso a internet mínimo de 3 Mbps de ancho de banda, o de dispositivos móviles (Android 5.1 o superior, iOS 9 o superior).
13.5. GESTIÓN DEL COMPONENTE DE TALENTO HUMANO Y CAPACITACIÓN.
a. Contar de manera permanente con el talento humano para el mantenimiento y seguimiento al sistema de información nominal del PAI, a nivel departamental, distrital, municipal, así como los prestadores de servicios de salud, conforme a lo establecido en la Circular 044 de 2013.
b. Garantizar el ingreso en tiempo real de la información, para lo cual deben brindar capacitación e inducción en el manejo del aplicativo al personal encargado del proceso, realizar proceso de inducción y reinducción proporcionando el apoyo logístico para el desarrollo de estas. Dicha capacitación se deberá realizar en cascada iniciando desde el nivel superior hasta llegar a cada uno de los prestadores de servicios de salud del territorio nacional.
c. Garantizar, en contextos étnicos, la capacitación, inducción y vinculación de gestores o promotores de salud propia, en los procesos de vacunación, según lo referido en la Circular 011 de 2018 y el documento emitido por este Ministerio "Orientaciones para la prevención, detección y manejo de casos de COVID-19 para población étnica en Colombia", publicado en: https://www.minsalud.gov.co/Ministerio/Institucional/Procesos%20y%20procedimientos/TEDS04.pdf
13.6. GESTIÓN DE LA INFORMACIÓN.
El reporte cuantitativo de dosis aplicadas contra la COVID-19 tendrá una frecuencia semanal, la entrega del reporte se realizará en el siguiente orden:
a. El día miércoles, las IPS antes de las 10:00 am tendrán que enviar al municipio el consolidado de dosis aplicadas durante los siete días anteriores, es decir, de miércoles a martes.
b. El día miércoles, los municipios antes de las 02:00 pm enviaran a la entidad territorial el consolidado de dosis aplicadas durante los siete días anteriores.
c. El día miércoles, la entidad territorial departamental o distrital antes de las 06:00 pm enviará al Ministerio al correo reportesvaccovid19@minsalud.gov.co el consolidado de dosis aplicadas durante los siete días anteriores
14.1 VIGILANCIA DE EVENTOS ADVERSOS POSTERIORES A LA VACUNACIÓN EAPV. <Numeral modificado por el artículo 5 de la Resolución 1703 de 2022. El nuevo texto es el siguiente:>
La vigilancia de los Eventos Adversos Posteriores a la Vacunación – EAPV contribuye a la detección temprana y clasificación adecuada de los casos producidos por vacunas Covid-19; de acuerdo con el Decreto 601 del 2021 “Por el cual se desarrollan las competencias frente a la vigilancia de los eventos adversos posteriores a la vacunación contra el Covid – 19 y se reglamenta el artículo 4o de la Ley 2064 de 2020.
14.2. ERRORES OPERATIVOS DEL PROGRAMA O ERRORES PROGRAMÁTICOS.
Definición: son eventos relacionados con cualquier error en la recepción, almacenamiento, conservación, distribución, manipulación, preparación, administración y capacitación del equipo de vacunación. El conocimiento de los posibles errores de programa puede ayudar a identificar las debilidades y las brechas en cada proceso operativo en el proceso de implementación y desarrollo que puede afectar al PNV para reevaluar mejoras, pudiendo evitar las consecuencias de los incidentes generados y a su vez identificación de EAPV (ver Tabla 6).
Tabla 3. Clasificación de error programático, definición término MedDRA para VigiFlow
| CLASIFICACIÓN FINAL Ministerio de Salud y Protección Social-INVIMA | TIPOS DE ERRORES PROGRAMATICOS |
| Vacunación errónea | Vacunación errónea, en esta persona, ¿hubo un error al momento de prescribir o no cumplimiento de las recomendaciones para el uso de la vacuna? (por ejemplo, receptor incorrecto, cambio de fabricante en el esquema de vacunación, etc.) |
| Intercambio de vacuna | Intercambio de vacuna: Persona a la que se aplicó segundas dosis de diferente laboratorio (intercambiabilidad de vacunas), por ejemplo, se aplica la primera dosis de Pfizer y la segunda de Sinovac. |
| Administración de vacuna caducada | Administración de vacunas caducadas: Corresponde a la vacuna que expiró (venció) de acuerdo con lo registrado en la etiqueta del producto. |
| Técnica aséptica inadecuada al utilizar un producto | Técnica aséptica inadecuada al utilizar el producto: administración de forma no estéril. |
| Administración de vacuna de baja calidad | Administración de vacuna de baja calidad: En esta persona, ¿la condición física de la vacuna (por ejemplo, color, turbidez, presencia de sustancias foráneas, etc.) era anormal al momento de su administración? |
| Técnica de reconstitución inapropiada | Técnica de reconstitución inapropiada: Cuando esta persona fue vacunada, ¿hubo un error al momento de la constitución/preparación de la vacuna por parte del vacunador? (por ejemplo, producto incorrecto, diluyente incorrecto, mezcla inadecuada, llenado de jeringa inapropiado, etc.) |
| Almacenamiento inapropiado de producto en uso | Almacenamiento inapropiado de productos en uso: En esta persona, ¿hubo un error en la manipulación de la vacuna? (por ejemplo, se interrumpió la cadena de frío durante el transporte, almacenamiento y/o sesión de vacunación, etc.) |
| Administración de dosis incorrecta | Administración de dosis incorrecta, cuando se aplican dosis incorrectas a las establecidas en los anexos técnicos de las vacunas, (rendimiento de frasco, aumento accidental de dosis en un paciente, intervalos en los tiempos de aplicación de vacuna erróneos, sitio o vía de administración incorrecto; tamaño de la aguja incorrecto, etc.) |
| Exposición inadvertida a una vacuna | Mujer en edad fértil vacunada para covid19, quien se le confirma embarazo posterior a la aplicación de la vacuna. |
Ante la presencia de un caso por error programático, teniendo en cuenta la tabla anterior, se debe clasificar y hacer el reporte por medio de herramienta Excel de manera temporal, (consultar a su coordinador PAI departamental o distrital), que nos permite generar la información de manera diaria y/o semanal para hacer la consolidación de los datos, mientras se establece un sistema de información a través de VigiFlow por Invima, con una estructura de reporte diario por parte de las IPS vacunadoras quienes con el apoyo del profesional de farmacovigilancia y PAI que ejecutan la vacunación contra la COVID-19. Se identificará de manera temprana las causas que afectan la seguridad del usuario, así como la cantidad de errores programáticos, para realizar en la IPS vacunadora junto con el municipio y departamento el respectivo seguimiento de fortalecimiento de las acciones de capacitación, educación al personal del PAI según el Manual técnico operativo del programa: Capitulo 6 vacunación segura e identificar el acumulado histórico de las 37 entidades que componen el territorio nacional.
14.2.1. PROCEDIMIENTO DE NOTIFICACIÓN DE ERRORES PROGRAMÁTICOS.
Reportar inmediatamente el incidente al coordinador PAI de la IPS vacunadora, del municipio, departamento o distrito de su jurisdicción. El error puede estar relacionado con el almacenamiento, manipulación o administración y se puede prevenir y evitar. Por lo tanto, se debe convocar a las áreas encargadas con la seguridad del paciente, oficina de calidad, talento humano, vigilancia epidemiológica, gestión del riesgo y farmacovigilancia de la IPS, con el fin de realizar análisis del caso y la investigación respectiva para establecer planes de mejora para evitar que este tipo de situaciones se presenten a futuro.
La IPS vacunadora adopta los lineamientos establecidos por el Ministerio de Salud y Protección Social, para garantizar que la vacunación contra el COVID-19 sea un proceso seguro para todos nuestros usuarios. '
14.2.2. REPORTE DE LOS ERRORES PROGRAMÁTICOS POSTERIORES A LA VACUNACIÓN CONTRA LA COVID-19.
Cuando los prestadores de servicios de salud consideren que existe un error programático posterior a la vacunación, deben notificarlo al Instituto Nacional de Vigilancia de Medicamentos y Alimentos - Invima, mediante el sistema VigiFlow, mediante la articulación del profesional de farmacovigilancia y PAI. La entidad territorial departamental o distrital debe realizar los ajustes correspondientes en dicha herramienta para su migración a Invima.
Cuando los prestadores de servicios de salud de la IPS Vacunadoras consideren que hay un error programático posterior a la vacunación, deben notificarlo a la secretaria de salud municipal y departamental o distrital o a la entidad que haga sus veces, con la orientación del personal de farmacovigilancia y PAI lo ingresaran en el sistema VigiFlow, los errores programáticos, como se describen en la Tabla 6.
14.3. SISTEMA DE REPORTE DE LA INFORMACIÓN.
1. La IPS vacunadora debe digitar en el sistema VigiFlow el error programático posterior a la vacunación, con el profesional de farmacovigilancia y PAI.
2. La IPS vacunadora debe enviar los soportes de la reunión e investigación con los representantes de la oficina de calidad, segundad del paciente, gestión del riesgo, farmacovigilancia, epidemiología y PAI del servicio, donde se debe analizar las fallas que generaron el error en el PAI, como: la técnica, la calidad de la vacuna y sus componentes además de la información clínica y epidemiológica. Cuando recolecte esta información, debe cargar los soportes al sistema VigiFlow con los profesionales de farmacovigilancia y PAI, que apoyarán la digitación en la IPS vacunadora y a la ET.
3. La ET departamental o distrital deberá identificar los casos de los errores programáticos de las IPS vacunadoras y enviarlos por medio de VigiFlow al Invima y al MSPS (formato Excel de errores programáticos).
4. Si el error no está digitado la ET debe solicitar a la IPS vacunadora realizar la notificación a VigiFlow de inmediato.
5. La ET debe verificar que los soportes estén en VigiFlow y hacer seguimiento del plan de mejora, evidenciar que no se presenten nuevos casos del mismo error programático en la IPS vacunadora.
6. La ET debe fortalecer los programas de capacitación y adherencia a los lineamientos de vacunación contra la COVID-19.
7. Componentes de la investigación del error programático que está a cargo de PAI y son:
a. Vacuna (lote, fecha de vencimiento, laboratorio y cadena de frío)
b. Usuario (identidad e historial de vacunación).
c. Vacunador (certificado, vacunación segura, capacitación continuada)
d. Brindar información del usuario afectado: si es menor de edad los padres o tutor (Relato del proceso de vacunación), si es adulto mayor él mismo, su acompañante o cuidador.
e. Observación y verificación de procedimientos técnicas de asepsia y antisepsia.
f. Revisión en PAIWEB: si está cargado en el sistema de información y verificar las vacunas previas.
g. Inspección del servicio y habilitación de prestación de servicios
La vacunación inadvertida en gestantes deja de ser un criterio para identificación como evento adverso posterior a la vacunación para las mujeres a partir de la semana doce (12) de embarazo.
Las mujeres gestantes notificadas vacunadas inadvertidamente hasta la semana once (11) de embarazo se les deberá realizar el respectivo seguimiento a cargo de las entidades responsables del aseguramiento en salud a la cual se encuentre afiliada.
La farmacovigilancia es la ciencia y las actividades relacionadas con la detección, evaluación, comprensión y prevención de los efectos adversos de los medicamentos o cualquier otro posible problema relacionado con los fármacos (The importance of pharmacovigilance. Safety monitoring of medicinal producís. Geneva: World Health Organizaron; 2002).
Para la farmacovigilancia se deben tener en cuenta los siguientes conceptos:
Tabla 4 Conceptos para farmacovigilancia
| Error de medicación | Incidente que puede evitarse y que es causado por la utilización inadecuada de un medicamento. Puede producir lesión a un paciente, mientras la medicación está bajo control del personal sanitario, del paciente o del consumidor. http://www.nccmerp.org/about-medication-errors |
| Fallo terapéutico, falta de eficacia (inefectividad terapéutica) | Falla inesperada de un medicamento en producir el efecto previsto, como lo determinó previamente una investigación científica. |
| Problemas relacionados con medicamentos | Situaciones que durante el uso de medicamentos causan o pueden causar un resultado negativo asociado con la medicación, incluyendo eventos adversos y otros. |
| Señal | Información reportada sobre una posible relación causal entre un evento adverso y un fármaco, siendo desconocida o incompletamente documentada previamente. Usualmente, se requiere más de un reporte para generar una señal. |
Fuente: Elaboración del Grupo de Gestión Integrada de Enfermedades Inmunoprevenibles -PAI-MSPS
El país actualmente tiene una cadena de frío fortalecida para el almacenamiento de los biológicos que hacen parte del esquema nacional de vacunación, garantizando las condiciones de almacenamiento en temperaturas de refrigeración entre +2°C a +8°C, así como, la cadena de frío de las vacunas contra la COVID-19 que requieren condiciones de almacenamiento con temperaturas de congelación o ultracongelación.
Este Ministerio utiliza para distribuir las vacunas contra la COVID-19, incluidas las que requieren conservación en temperaturas de congelación y ultracongelación, la misma logística que usa dentro del programa regular de vacunaciones es decir, realiza las entregas a las entidades territoriales departamentales y distritales bajo unos estándares preestablecidos y empleando en su mayoría transporte aéreo, con inclusión de transporte terrestre para las ciudades cercanas, estos a su vez distribuyen hacia los centros de acopio municipales.
15.1. CONDICIONES DE ALMACENAMIENTO.
La vacuna se debe almacenar y transportar según las normas del manual técnico-administrativo del PAI y las que se señalan a continuación:
a. Conservar la vacuna a una temperatura según los rangos declarados por el fabricante (ver anexo técnico para la aplicación de la vacuna).
b. Cumplir con las indicaciones técnicas relacionadas con la conservación y periodo de validez para viales cerrados y abiertos, establecidas por cada uno de los laboratorios fabricantes.
c. Contar con procesos de recepción de vacunas e insumes, que permitan verificación las condiciones de llegada a cada institución.
d. Contar con instrumentos de medición debidamente calibrados.
e. Realizar la toma de temperaturas de almacenamiento de vacunas e insumos dos veces al día los 365 días del año según los procedimientos del programa o implementar sistemas de monitoreo continuo para su verificación.
f. Realizar monitoreo de temperaturas continuo durante el transporte de las vacunas.
g. Las vacunas ultracongeladas o congeladas, una vez inicien el proceso de descongelación para ser almacenadas en refrigeración +2°C a +8°C, no pueden volver a ser expuestas a temperaturas de ultracongelación o congelación.
h. Contar con contratos de mantenimiento preventivo y correctivos de la totalidad de los equipos que hacen parte de la cadena de frío, para garantizar el correcto funcionamiento de estos.
i. Contar con un plan de contingencia ante cualquier evento que afecte la seguridad de las vacunas o insumos.
j. Reportar los casos de excursiones que se presenten, según el procedimiento que se tenga estandarizado para reportar al Invima.
k. Emplear los elementos de protección personal para el manejo de la cadena de frío.
l. Para la presentación multidosis, NO se deben dejar agujas insertadas en el tapón de jebe, ni sumergir el frasco en agua, ni pre llenar jeringas.
15.2. MANEJO DE VACUNAS ULTRACONGELADAS O CONGELADAS.
Las entidades territoriales que tengan bajo su responsabilidad las vacunas ultracongeladas o congeladas deben contar con los equipos apropiados para su almacenamiento, transporte y monitoreo, así como el personal debidamente capacitado para el manejo de estas temperaturas y el uso de los elementos de protección personal requeridos.
Siempre se debe tener claridad de los tiempos permitidos para el manejo de cada rango de temperaturas según las recomendaciones de los fabricantes. (Ver anexo técnico de cada una de las vacunas).
El hielo seco es la forma congelada del dióxido de carbono, cuando se calienta éste se transforma directamente en un gas (sublimación). Los principales riesgos de su manejo son:
Asfixia: En espacios pequeños, cerrados y con poca ventilación puede reducir la cantidad de oxígeno en el ambiente.
Quemaduras: No manipule el hielo seco sin la debida protección, la piel nunca debe entrar en contacto con este, se debe utilizar guantes aislantes e impermeables, lentes de protección de ojos con aletas laterales o careta.
Adicionalmente se debe tener en cuenta las siguientes reglas:
a. Dar cumplimiento a las normas de seguridad y salud en el trabajo, y realizar de manera conjunta con la ARL, el análisis de riesgo (evaluación, gestión y comunicación del riesgo) por uso de hielo seco.
b. Realizar seguimiento y monitoreo permanente de las condiciones de uso del hielo seco.
c. Garantizar el uso obligatorio de los elementos de protección personal de acuerdo con las condiciones de manejo del hielo seco.
d. Realizar la capacitación al personal técnico y operativo para la manipulación segura del hielo seco.
e. Evitar el contacto con cualquier parte del cuerpo, si esto ocurre busque atención médica según lo indicado en la hoja de datos de seguridad sobre el hielo seco.
f. No se debe ingerir el hielo seco.
g. No almacenar en espacios cerrados o con poca ventilación.
h. No colocarlo en recipientes totalmente herméticos.
i. Abrir las puertas o tapas con el fin de que se ventile el área de manera adecuada, si el hielo seco ha estado en un área encerrada, remolque o contenedor.
j. Abandonar el área inmediatamente frente a falta de aire o dolor de cabeza, ya que estos pueden ser signos de inhalación excesiva de dióxido de carbono, en tal caso se debe informar al profesional responsable de seguridad y salud en el trabajo.
15.2.2 MANEJO PARA LA ELIMINACIÓN DE HIELO SECO.
Una vez que ya no se requiera el hielo seco, se recomienda utilizar baldes o canecas sin tapa con el fin de que se vaya sublimando de manera gradual, en un área ventilada o exterior protegida y vigilada, en las que se mantenga al personal alejado y seguir las disposiciones de la gestión integral de residuos o desechos. En el proceso de eliminación del hielo seco se debe tener en cuenta:
a. NO dejarlo en un área cerrada o recipiente hermético sellado.
b. NO dejarlo en un área de fácil acceso para cualquier usuario.
c. Dejarlo en un área controlada o vigilada.
d. NO colocarlo en lavamanos, lava termos o desagües ni tampoco arrojarlo al inodoro.
e. NO desecharlo con los demás residuos.
16. ESTRATEGIA DE COMUNICACIÓN.
Las entidades territoriales, entidades responsables del aseguramiento y los prestadores de servicios de salud, en el ámbito de sus competencias deben generar e implementar estrategias de comunicación efectiva que contribuyan al logro de objetivos propuestos del PNV contra la COVID-19; dirigidas a informar, educar y sensibilizar a la población sobre la gravedad de la enfermedad respiratorio SARVCO2 y generar confianza en la vacunación para lograr la mayor cobertura y resultados en salud.
Para el logro de resultados de vacunación contra la COVID-19, es determinante contar con el fortalecimiento de este componente, en la sensibilización y difusión de manera permanente sobre la gravedad de esta enfermedad y generar confianza en la vacunación, para que acudan al punto de vacunación a iniciar, continuar y completar el esquema de vacunación. Las EAPB y las Entidades Territoriales departamentales, distritales y municipales tendrán la responsabilidad de establecer y poner en marcha su plan de comunicaciones dirigidos al logro de los siguientes objetivos:
--Sensibilizar a la población sobre la gravedad de esta enfermedad.
--Generar confianza en la vacunación en grupos de alto riesgo.
--Evitar rumores y desinformación.
--Generar estrategias de seguimiento y demanda inducida, que garanticen completar el esquema en la población mayor de 3 años y lograr las metas de las poblaciones sujeto.
--Fortalecer la detección y notificación de posibles casos de Eventos Adversos Posteriores a la Vacunación.
La presentación de Eventos Adversos Posteriores a la Vacunación puede generar pérdida de confianza de la población en forma abrupta, lo cual puede distraer recursos en forma inesperada para contrarrestar el efecto negativo de las declaraciones inapropiadas de los medios de comunicación. Situaciones que tiene explicación científica, pueden verse mal interpretadas por la población si hay una canalización inadecuada de los mensajes. La demanda de información puede ocasionar una crisis, no solo para la intensificación sino para el sector pues se puede caer en la improvisación, por falta de estrategias previamente definidas. Las consecuencias de esto serán una población atemorizada, una demanda o acoso excesivo de los medios. El costo de restablecer la confianza será la movilización de recursos adicionales para equilibrar la confianza, que distraerá recursos destinados a la intensificación de vacunación.
Por lo anterior, cada uno de los niveles territoriales junto con la oficina de comunicaciones o quien haga sus veces deberá liderar, elaborar y socializar el Plan de Crisis en conjunto con las entidades responsables del aseguramiento y las instituciones prestadoras de salud, que persiga los siguientes objetivos:
a. Determinar las conductas a seguir frente a los medios de comunicación para confrontar un Evento Adverso Posterior a la Vacunación.
b. Establecer un equipo de crisis: jefe, técnicos y voceros.
c. Identificar personas claves que deben estar informadas y elaborar directorio telefónico.
d. Identificar estrategias de comunicación para contrarrestar efectos negativos.
e. Asegurar que TODOS conozcan a los voceros oficiales.
f. Definir mensajes
g. Establecer calendario de capacitaciones
h. Definir y asignar tareas.
El equipo de crisis debe estar conformado por el Secretario de Salud, el responsable de vigilancia en salud pública, el coordinador del PAI, el coordinador de salud pública, entre otros, de la entidad territorial que estén al frente de la crisis; este equipo debe ser multidisciplinario, cumplir con los objetivos del plan de crisis y contar con un vocero quien dará la información respectiva a los medios de comunicación. Este equipo y conforme a la situación debe:
a. Promover las conferencias de prensa, boletines diarios, entre otros.
b. Supervisar el material para los medios.
c. Instalar una sede donde brindar información permanente sobre cualquier situación inesperada, donde se pueda capacitar además a los comunicadores y periodistas.
d. Facilitar historias sobre la vida real, de situaciones similares en otros países y lugares del país.
e. Asegurar la entrega de materiales a la prensa y darles seguimiento.
f. Emitir boletines de prensa para todo el país.
g. Es muy importante contar con un plan de crisis, ya que con el:
--Se mantiene una imagen positiva de la vacunación con argumentos sólidos, oportunos y confiables.
--Se brinda confianza en el sector salud con la organización minuciosa de la información crítica
--Se fortalecen los vínculos, alianzas y confianza con la población y con los medios.
Dentro del plan de comunicaciones se pueden utilizar diversas e incluyentes herramientas informativas de acuerdo con las características y lenguaje propio de cada territorio:
a. Cuñas en radio y televisión, nacional, regional o comunitaria.
b. Carro valla con sonido/ Perifoneo
c. Página WEB y boletines electrónicos
d. Redes sociales
e. Piezas en transporte masivo
f. Boletines, revistas o periódicos, folletos, afiches, pendones u otro material impreso
17. CAPACITACIÓN TALENTO HUMANO.
El componente de capacitación es un elemento clave para asegurar que todo el personal de salud conozca y cumpla la normativa de los procesos a desarrollar para lograr los objetivos del PNV contra la COVID-19 según los lineamientos establecidos.
Además de garantizar el aprendizaje continuo del talento humano que coordina, gestiona y opera la vacunación a través de la documentación y difusión de lecciones aprendidas y buenas prácticas.
Socializar el contenido del presente documento, así como otros temas técnicos que se considere pertinente y necesario reforzar al personal de todos los niveles (departamental, distrital, municipal, entidades promotoras de salud, entidades adaptadas, regímenes Especial y de Excepción, instituciones prestadoras de servicios de salud).
18. REDUCCIÓN DE OPORTUNIDADES PERDIDAS EN VACUNACIÓN.
Se conoce como oportunidades pérdidas de vacunación (OPDV) aquella en la que una persona en la que está indicada la vacunación y no presenta ninguna contraindicación acude a los servicios de salud y NO recibe las vacunas. (OPS, Metodología para la evaluación de oportunidades perdidas de vacunación)
Los programas de vacunación en su operación regular tienen en cuenta para su operación un porcentaje de vacuna que se adjudica a pérdidas que llegan a ocasionarse cuando se capta población susceptible y no se aplica la totalidad de dosis contenidas en un vial, esto es algo que se acepta para lograr una elevada cobertura, especialmente cuando las vacunas se presentan en viales o frascos multidosis.
Teniendo en cuenta lo anterior y con el fin de reducir las OPDV, en los casos en los que no se cuente con la población suficiente para aplicar la cantidad completa de dosis de un vial, deberá primar la garantía del derecho a la vacunación de las personas contra la COVID-19 y por lo cual serán aceptables las pérdidas de biológicos asociadas con la apertura de viales en presentaciones multidosis.
18.1 POLÍTICA DE FRASCOS ABIERTOS.
La política de frascos abiertos hace referencia al tiempo máximo que puede durar un vial de vacuna después de abierto para el uso de las dosis incluidas y que varía según el fabricante, para su implementación deben cumplir con las siguientes condiciones:
a) Las vacunas no deben estar vencidas (vida útil vigente del producto a utilizar).
b) Las vacunas deben estar almacenadas y conservadas en condiciones apropiadas de cadena de frío, manteniendo la vacuna a temperatura entre +2 y +8 grados °C.
c) Garantizar la utilización de técnica aséptica en la-extracción del biológico.
d) El tapón del frasco de la vacuna no debe haberse sumergido en agua debido al descongelamiento de los paquetes fríos. El frasco debe permanecer limpio y seco.
e) Registrar la hora y fecha de la reconstitución de cualquier vacuna multidosis y nunca dejar la aguja insertada en el tapón del frasco con el fin de evitar la contaminación.
f) Nunca debe ser utilizado un vial que le falte la etiqueta, o cuya información no se pueda leer o no sea clara.
g) Garantizar que los equipos utilizados en vacunación cuenten con código PQS (refrigeradores, cajas térmicas y termos), y realizar las buenas prácticas para la conservación de los biológicos garantizando la conservación con temperatura entre +2 y +8 grados °C, lo cual incluye el recambio de los paquetes fríos.
h) Desarrollar un proceso de capacitación, monitoreo y evaluación en todas las Instituciones Prestadoras de Servicios vacunadoras del país para implementar correctamente la política de frascos abiertos.
Para la vacuna contra la COVID-19 la política de frasco abierto debe ser aplicada según las indicaciones de cada uno de los laboratorios fabricantes, es decir, aplicar el tiempo de la vida útil del vial después de ser perforado, así:
Tabla 5 Política Frascos Abiertos vacunas contra la COVID-19
| Laboratorio | Presentación | Necesita reconstitución | Vida útil después de vial perforado |
| Pfizer y BioNTech | Liquida | SI | 6 horas |
| AstraZeneca | Liquida | NO | 48 horas |
| Janssen | Liquida | NO | 6 horas |
| Moderna | Liquida | NO | 19 horas |
| Sinovac | Liquida | NO | 2 dosis: 8 horas |
| Liquida | NO | 1 dosis: inmediato | |
19. SEGUIMIENTO A DOSIS PERDIDAS DE VACUNACIÓN CONTRA LA COVID-19.
Los biológicos e insumes para la vacunación contra la COVID-19, son catalogados como bien público, por lo cual se ubican en el contexto de los artículos 63 y 102 de la Constitución Política Colombiana de 1991; artículos 42 y 43 de la Ley 715 de 2001; Articulo 24 de la Ley 734 de 2002.
De igual manera, la Ley 190 de 1995, establece que los servidores públicos deben informar de deterioro, daño o pérdida de bienes públicos conforme a lo definido en los numerales 21, 22, 24 y 25 de la citada norma:
En caso de materializarse la pérdida de biológicos se debe diligenciar el acta en la que se documente la situación ocurrida que incluya: tipo de vacuna o insumo, número de unidades/dosis afectadas, lote, fecha de vencimiento, laboratorio productor, posible causa por la cual ocurrió la pérdida.
Los motivos de pérdidas que se pueden presentar en el desarrollo del proceso de vacunación son:
Tabla 9. Motivos de pérdidas de vacunas contra la COVID-19
| N° | Motivo de pérdida | Concepto | Requieren registro en PAIWEB 2.0 y SÍSPRO | Requieren elaboración de plan de acta de baja | Requieren elaboración de plan de mejora |
| 1 | Política de frascos abierto | Dosis pérdidas de acuerdo con las indicaciones del laboratorio productor en la estrategia intramural o extramural. | SI | SI | NO |
| 2 | Interrupción de la cadena de frío | Vacuna COVID-19 con concepto técnico de NO USO por parte del Invima. | Si | SI | SI |
| 3 | Contaminación del biológico | Dosis pérdidas debido a que el vial se contaminó durante el proceso de almacenamiento, alistamiento, envasado, aplicación de la vacuna COVID-19, entre otras, inmersión del vial, agujas permanentes insertadas sobre el tapón del frasco, mala manipulación. | SI | SI | SI |
| 4 | Error en la manipulación | Corresponde a la aguja mal empatada que provoca pérdida del producto.Derrame o ruptura del biológico durante el alistamiento, reconstitución o administración.Partículas extrañas del tapón al interior del frasco/vial que se identifican posterior al proceso de reconstitución. | SI | Sí. | SI |
| 5 | Error en la reconstitución/dilución | Vacuna COVID-19 reconstituida o diluida con diluyente que no le corresponde según las indicaciones del fabricante.Reconstitución o dilución con menor o mayor cantidad de mililitros a los indicados por el fabricante. | SI | SI | SI |
| 6 | Error en la dosificación | Corresponde a la persona vacunada contra COVID-19 con mayor o menor cantidad de dosis aplicada respecto a la indicación farmacéutica y los lineamientos nacionales. | SI | SI | SI |
| 7 | Vacuna que excede el tiempo de almacenamiento en refrigeración | Corresponde a la vacuna que superó los días de almacenamiento en temperaturas de refrigeración según las indicaciones del laboratorio fabricante. | SI | SI | No |
| 6 | Vencimiento del biológico | Corresponde a la vacuna que expiró (venció) de acuerdo con lo registrado en la etiqueta del producto. | SI | SI | No |
| 9 | Frasco vial roto | Corresponde a las dosis de un (unos) viales identificado roto o fracturados durante el proceso de transporte nacional, municipal, IPS o extramural. | SI | SI | SI |
| 10 | Fallas de fabricación/calidad | Corresponde a frasco/vial de vacuna COVID- 19 sin producto, sin etiqueta, cambios de coloración del producto, partículas dentro del vial identificadas previas a la reconstitución, caja incompleta u otros aspectos del producto diferentes al indicado por el fabricante. | SI | SI | NO |
| 11 | Siniestro/Accidente | Vacuna pérdida en siniestros como inundaciones, incendios, desastres naturales, entre otros. | SI | SI | SI |
| 12 | Robo/hurto biológico | Vacuna COVID-19 que fue hurtada durante el almacenamiento, transporte, distribución a nivel departamental, municipal, IPS o extramural. | SI | SI | SI |
1. En el caso de pérdida de cadena de frío las vacunas deben ser conservadas en temperatura - de +2 a +8°C y seguir el procedimiento establecido por el Invima, para lo cual se deben notificar el evento a los correos dclopeza@minsalud.gov.co y nazuluaga@minsalud.gov.co.
2. Cuando la pérdida está relacionada con falla de calidad o fabricación estas deben ser conservadas en temperatura de +2 a +8 °C, diligenciar el acta de baja en la que se documente la situación adicionando registro fotográfico y ser adicionalmente notificadas al correo perdidascovid@minsalud.gov.co adjuntando los soportes pertinentes.
3. Remitir copia de acta a entidad superior o a la autoridad competente que haga sus veces.
4. Elaborar plan de mejoramiento en los motivos de pérdidas que lo requieren como se describe en la tabla 9 para evitar que ocurran hechos similares en el futuro, estableciendo fechas, responsables de su implementación y seguimiento en los diferentes niveles jerárquicos.
5. Remitir copia del plan de mejoramiento a la secretaria de Salud departamental o al nivel superior y copia del avance del plan.
6. Una vez se surte el proceso de notificación y curse el proceso de investigación por la autoridad competente y se demuestre responsabilidad en la pérdida de los bienes públicos. Al respecto, es importante mencionar que existen motivos de pérdidas que son propios del proceso de vacunación, como ocurre con las asociadas a fallas de calidad del biológico y política de frascos abiertos.
Ahora bien, teniendo en cuenta que las fallas de calidad están asociadas al proceso de producción de las casas farmacéuticas, las dosis reportadas por parte de los agentes del sistema deben ser tramitadas por parte del MSPS a través de las casas farmacéuticas para la respectiva reposición, atendiendo el mecanismo de adquisición que corresponda
Se procede al reembolso de los biológicos objeto de pérdida, conforme al reporte del costo que se registre en los documentos soportes de entrega de las vacunas.
Así las cosas, las perdidas atribuidas a fallas de calidad y las relacionadas con política de frascos abiertos o para reducción de oportunidades perdidas de vacunación, no deberán generar proceso de reintegro. Las demás causales están sujetas a los procesos administrativos propios de la investigación ejercida para determinar la responsabilidad del reintegro.
Las vacunas que no sean aplicadas antes de su fecha de vencimiento serán consideradas como dosis pérdidas por causas programáticas y deberán ser reportadas en el enlace de SISPRO habilitado: https://tcvacunacionfrontprd.azurewebsites.net/formulario y en el módulo de inventario de PAIWEB 2.0.
En caso de perdidas por vencimiento, se deberán analizar los datos de la población objeto del área de influencia del punto de vacunación, a fin de determinar si la perdida requiere reintegro.
20. SEGUIMIENTO, SUPERVISIÓN Y EVALUACIÓN.
Se deberá realizar seguimiento permanente a la ejecución del Plan Nacional de Vacunación contra la COVID-19, con el objetivo de identificar oportunamente necesidades de intervención y apoyar la toma de decisiones en la gestión.
20.1. SEGUIMIENTO Y SUPERVISIÓN.
a. Monitorear el cumplimiento de las metas de vacunación contra la COVID-19 semanalmente.
b. Identificar la población no vacunada, para realizar la programación y vacunación.
c. Formular el plan de intervención en zonas identificadas con población susceptible no vacunada.
c. Identificar las situaciones (amenazas) que puedan afectar el desarrollo de la vacunación contra la COVID-19.
d. Establecer plan de alternativas de solución a través de planes de mejoramiento.
a. Verificar el cumplimiento de las coberturas e indicadores de los criterios de calidad de la vacunación contra la COVID-19.
b. Determinar las fortalezas, oportunidades, debilidades y amenazas para la vacunación contra la COVID-19.
c. Identificar y documentar las lecciones aprendidas y buenas prácticas en el desarrollo del plan de acción del PAL
d. Seguimiento a indicadores (ver la siguiente tabla)
Tabla 6 Indicadores
| INDICADOR* | DESCIPCION DE LA VARIBLE | ||
| 1. | % de cobertura de vacunación contra la COVID- 19 (Segundas dosis más dosis únicas) a nivel nacional, departamental, distrital y municipal | Número de personas vacunas contra la COVID- 19 con esquema completo** | X 100 |
| Total, de población proyección DANE | |||
| 2. | % de cobertura de Iros refuerzos de vacunación contra la COVID-19 (Iros refuerzos a los 4 meses de terminar el esquema primario) a nivel nacional, departamental, distrital y municipal | Número de personas vacunas contra la COVID- 19 con 1er refuerzo | X 100 |
| Total, de población vacunada contra la COVID - 19 con esquema completo** | |||
| 3. | % de cobertura de vacunación en población gestante a nivel nacional, departamental, distrital y municipal | Número de gestantes vacunas contra la COVID- 19 | X 100 |
| Total, de población gestante a nivel nacional, departamental, distrital y municipal | |||
4. | % de cobertura de vacunación en población migrante regular a nivel nacional, departamental, distrital y municipal | Número de migrantes regulares vacunados contra la COVID-19 | X 100 |
| Total, de población migrante regular a nivel nacional, departamental, distrital y municipal | |||
| 5. | % de cobertura de vacunación en población de 3 a 11 años a nivel nacional, departamental, distrital y municipal | Número de población de 3 a 11 años vacunados contra la COVID-19 | X 100 |
| Total, de población de 3 a 11 años proyección DANE | |||
*Estos indicadores se deben evaluar de manera semanal, quincenal y mensual
* El esquema completo de vacunación se medirá con las segundas dosis más las únicas aplicadas.
CONSENTIMIENTO INFORMADO PARA LA APLICACIÓN DE LA VACUNA CONTRA EL SARS-COV-2/ COVID-19.
<Anexo sustituido por el anexo 2, según artículo 6, de la Resolución 1703 de 2022. El TEXTO ORIGINAL es el siguiente:>
CIUDAD___________ FECHA: DÍA____ MES____ AÑO________ HORA:
DATOS DE IDENTIFICACIÓN DE LA PERSONA
NOMBRES_______________________ APELLIDOS ___________________________
TIPO DE IDENTIFICACIÓN: RC__TI__CC__CE__ OTRO_____NÚMERO _________
FECHA DE NACIMIENTO DÍA_________ MES______ AÑO ______EDAD _____AÑOS
NOMBRE DE LA EAPB RESPONSABLE______________________________________
MUJER EN ESTADO DE EMBARAZO SI _____ NO ____ NO APLICA ____
INFORMACIÓN PREVIA. La vacunación es una forma segura y eficaz de prevenir enfermedades y salvar muchas vidas. En la actualidad el país dispone de vacunas para proteger contra al menos 26 enfermedades, entre ellas, la difteria, el tétanos, la tos ferina, la poliomielitis, la hepatitis, el cáncer de útero y el sarampión. Con la aplicación de las vacunas las personas se protegen a sí mismas y a quienes las rodean.
La vacunación contra el SARS- CoV-2/COVID-19 reducirá la posibilidad de presentar la enfermedad. En esta etapa de la emergencia, en la cual se inicia la aplicación de esta vacuna, se han reconocido beneficios y riesgos, que es importante que usted conozca antes de dar el consentimiento para su aplicación. Esta vacuna tiene Aprobación de Uso de Emergencia y surtió los pasos para la validación científica y sanitaria que permite su aplicación segura en humanos.
DATOS IMPORTANTES DE LA VACUNA (por favor, leer con detenimiento. Puede formular preguntas)
| ¿CÓMO SE APLICA? | Administración vía intramuscular en el brazo (tercio medio del músculo deltoides). |
| VACUNA Y DOSIS | Nombre de la vacuna a aplicar _______________Primera dosis ______ segunda dosis ______dosis única ___ |
| BENEFICIOS | Prevención de la enfermedad COVID-19, causada por el virus SARS-CoV-2.Reducción de la severidad de la enfermedad en caso de presentarse. Potencial protección del entorno familiar y los allegados. |
| RIESGOS | Presentación de efectos adversos a corto y mediano plazo posterior a su aplicación como: dolor en el sitio de inyección, dolor de cabeza (cefalea, articulaciones (artralgia), muscular (mialgia); fatiga (cansancio); resfriado; fiebre (pirexias); enrojecimiento e inflamación leve en el lugar de la inyección; inflamación de los ganglios (linfadenopatía); malestar general; sensación de adormecimiento en las extremidades, reacciones alérgicas leves, moderadas o severas.Estos no se presentan en todas las personas. |
| ALTERNATIVAS | A la fecha no se ha identificado otra medida farmacológica más eficaz que la vacunación para la prevención de la COVID-19. |
INFORMACION ESPECIFICA PARA GESTANTES
Esta tiene aprobado el uso en mujeres gestantes desde la semana doce (12) y durante los 40 días postparto, siempre que los posibles beneficios superen los posibles riesgos con base en la evaluación clínica realizada en conjunto por el médico tratante y la gestante.
La vacuna que se le está administrando es eficaz para evitar complicaciones severas y muerte por SARS CoV-2 COVID-19 en la gestante, en el feto o neonato.
A la fecha no hay pruebas que la vacuna cause efectos adversos diferentes a los observados en la población general importantes para la mujer embarazada, el feto o la placenta.A nivel poblacional son muchos mayores los beneficios de administrar el biológico, sobre los riesgos de llegar a padecer COVID-19 durante la gestación, por el impacto qué sobre la salud materna y perinatal produce la infección por SARS-CoV-2 y ante el alto riesgo de complicaciones severas, ingreso a UCI, morbilidad y mortalidad materna y fetal asociada a esta enfermedad.Manifiesto que soy mujer con más de 12 semanas de gestación o que me encuentro dentro de los 40 días postparto y realicé previamente la evaluación riesgo - beneficio junto con mi médico.
EXPRESIÓN DE LA VOLUNTAD
De manera voluntaria, después de haber recibido información por el personal de salud clara, concreta, sencilla y en términos acordes con mi condición, así como las explicaciones adecuadas, informo que comprendo los beneficios, riesgos, alternativas e implicaciones de la aplicación de la vacuna que se me ofrece. De la misma manera, se me han indicado las recomendaciones que debo seguir, de acuerdo con la información entregada por el laboratorio productor de la vacuna.
Entiendo que la suscripción de este documento constituye una expresión autónoma de mi voluntad, y que NO tiene por objeto eximir de responsabilidad a las autoridades sanitarias o gubernamentales ni a las entidades que participaron en la aplicación de la vacuna contra el SARS-CoV-2/COVID-19 de brindar la atención en salud que sea necesaria por la aparición de posibles reacciones adversas no reportadas.
En consecuencia, decido ACEPTAR: ___que se me aplique la vacuna. NO ACEPTAR: ___ que se me aplique la vacuna.
Firma de la persona: __________________
En caso de requerirse, identificación y firma del representante legal:
Nombres ___________________________
Apellidos ___________________________
Tipo de Identificación: CC ___CE ___OTRO ___Número __________________
Firma _____________________
En caso de requerirse firma a ruego:
En virtud de que la persona a vacunar, __________________________________ identificado (a) con C.C. ___ C.E.____ OTRO _____ Número ________ de ________ no sabe o no puede firmar, a su ruego firma ________________________________________ identificado (a) con C.C. ___ C.E. ____ OTRO ____ número ________de _______________.
______________________________ _______________________
Huella dactilar o plantar del rogante Firma del rogado
c.c. _____________________ c.c. _________________
Nombres y apellidos del vacunador __________________________________
Firma _____________________
Tipo de Identificación: CC ____CE _____OTRO ____Número _____________
DATOS DE LA INSTITUCION
INSTITUCIÓN PRESTADORA DE SERVICIOS SALUD (IPS) _____________________
DEPARTAMENTO/DISTRITO____________________ MUNICIPIO: ________________
Nota: Los menores de edad deben firmar junto con uno de sus padres o su representante legal.
Tipos de documentos de identidad: RC: Registra Civil, TI: Tarjeta de Identidad, CC: Cédula de ciudadanía, CE: Cédula de extranjería
El usuario manifiesta que requiere segunda dosis de refuerzo por recomendación médica
Firma de la persona: ____________________________
ANEXO TÉCNICO PARA LA APLICACIÓN DE LA VACUNA BNT162B2 PFIZER-BIONTECH CONTRA LA COVID-19.
Composición
--Es una vacuna de ARN mensajero (ARNm) monocatenario, con caperuza (CAP) en el extremo 5', que codifica la proteína S (espícula) del virus SARS-CoV-2.
--El ARNm se produce por transcripción in vitro, a partir de un modelo de ADN, en un medio acelular.
--Cada dosis de 0,3 mi contiene 30 pg de este ARNm altamente purificado incluido en nanopartículas lipídicas.
--La vacuna contiene los siguientes excipientes:
- ALC-0315=((4-hidroxibutil) azanodiil) bis (hexano-6,1-diil)bis(2-hexildecanoato) (ALC-0315)
- ALC-0159=2-[(polietilenglicol)-2000]-N, N-ditetradecilacetamida (ALC-0159)
- 1,2-diestearoil-sn-glicero-3-fosfocolina (DSPC)
- colesterol
- cloruro potásico
- fosfato dihidrogenado de potasio
- cloruro sódico
- hidrógeno fosfato disódico dihidrato
- sacarosa
- agua para inyección
Mecanismo de acción
La vacuna contra la COVID-19 denominada BNTi62b2 es ARNm (ácido ribonucleico mensajero) de una sola hebra altamente purificado que contiene la secuencia genética de la proteína viral S que se encuentra en la superficie del virus SARS-CoV-2, rodeada en una envoltura lipídica (denominada nanopartícula) para permitir su transporte a las células en el cuerpo.
Cuando se inyecta, el ARNm es absorbido por las células de la persona vacunada que traducen la información genética y producen las proteínas S, activando el sistema inmunológico para que produzca anticuerpos específicos y active las células T para responder a cualquier exposición futura al unirse a la proteína S del virus SARS-CoV2 y bloquear la acción de cualquier virus que encuentre (1).
Al no contener virus vivos ni genoma completo, la vacuna no tiene capacidad replicativa y no puede producir la enfermedad. Al procesarse el ARNm directamente en el citoplasma, no se puede integrar en el genoma del huésped. Una vez entregado el mensaje y realizada la función de elaborar la proteína S el ARNm se degrada de forma natural.
Presentación, forma farmacéutica e indicación terapéutica
Presentación: vial multidosis que debe diluirse antes de su uso. 1 vial (0,45 mi) contiene 6 dosis de 30 microgramos de BNTi62b2 (incrustado en nanopartículas lipídicas).
Forma farmacéutica: Concentrado para solución inyectable. La vacuna es una solución congelada de color blanco a blanquecino.
Indicaciones terapéuticas: Inmunización activa para prevenir la COVID-19 causado por el coronavirus de tipo 2 causante del síndrome respiratorio agudo severo (SARS-CoV-2) en personas mayores de 12 años (2).
Conservación (3)
--Los frascos de la vacuna ultracongelada pueden mantenerse hasta por 9 meses a una temperatura de almacenamiento entre -60°C y -90°C, ó almacenarse en un rango de temperatura de -25°C a -15°C hasta por dos semanas en dosis con formulación de buffer de fosfato.
--Durante el almacenamiento se debe mantener protegido de la luz (luz solar directa y ultravioleta).
--Una vez descongelada, la vacuna sin diluir puede almacenarse hasta por 1 mes entre +2°C y +8°C.
--Diluida la vacuna debe usarse dentro de las 6 horas siguientes.
Eficacia
La eficacia de la vacuna BNTis2b2 fue de 95% (IC 95% 90.3%-97.6%) (4), 7 días después de la dosis 2 de la vacuna comparada con las personas que recibieron placebo (sustancia inocua diferente a la vacuna).
El efecto protector de la vacuna puede verse afectado por el manejo inadecuado de la cadena de frío, las técnicas de dilución y de aplicación. ¦
Dosis, vía, y sitio de administración
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1a dosis(Considérese día 0) | 0.3 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho. |
| 2a dosis(21 días después de aplicada la primera dosis) | |||
| Refuerzo (3)(intervalo de 4 meses de la segunda dosis o del primer refuerzo). | |||
Nota: No inyectar la vacuna por vía intravascular, subcutánea o intradérmica
Administración (5)
--La vacuna DEBE mezclarse con su diluyente antes de la administración.
--La serie de vacunas de ARNm contra la COViD-19 consta de dos dosis.
--La población de 12 años en adelante se aplicará la segunda dosis de vacuna con un intervalo de 21 días. Los errores de administración de vacunas deben informarse al sistema de notificación (ver vigilancia de EAPV).
Si no es posible cumplir con el intervalo recomendado y es inevitable un retraso en la vacunación, la segunda dosis de las vacunas Pfizer-BioNTech COVID-19 debe administrarse lo más pronto posible.
Observación post-vacunación
Durante el estudio clínico no se presentaron reacciones alérgicas graves; sin embargo, debido a algunas reacciones alérgicas presentadas posterior al inicio de la vacunación, el fabricante recomienda que las personas vacunadas permanezcan en observación. Se debe informar al usuario de las posibles reacciones adversas y cuales deben ser las conductas en caso de presentarse.
Intercambiabilidad
No hay datos disponibles sobre la intercambiabilidad de la vacuna BNTi62b2 con otras vacunas de COVID-19 para completar la serie de vacunación primaria. No se ha evaluado la seguridad y eficacia de una serie de productos mixtos. La recomendación basada en la evidencia es completar ambas dosis de la serie con la misma vacuna.
Coadministración con otras vacunas
--Según el CDC, las vacunas COVID-19 y otras vacunas se pueden administrar al mismo tiempo. Esto incluye la administración simultánea de vacunas COVID-19 y otras vacunas el mismo día, así como dentro de los 14 días. Al decidir si coadministrar otra (s) vacuna (s) con las vacunas COVID-19, los proveedores deben considerar si el paciente está atrasado, en riesgo de retrasarse- con las vacunas recomendadas o en alto riesgo de enfermedad prevenible por vacuna (7) (p. Ej., Durante un brote o exposiciones ocupacionales de rabia, fiebre amarilla, hepatitis B, meningococo, neumococo, influenza, entre otras. Pfizer está adelantado estudios de coadministración de esta vacuna con neumococo e influenza).
--Si se administran varias vacunas en una sola visita, administre cada inyección en un lugar diferente. Para adolescentes y adultos, el músculo deltoides puede usarse para más de una inyección intramuscular.
Preparación de la vacuna
Procedimiento para la descongelación de la vacuna
El vial multidosis se almacena en ultracongelación y debe descongelarse antes de la dilución, así:
Tabla 1. Procedimiento para la descongelación de la vacuna contra el COVID-19 laboratorio Pfizer- BioNTech
| La caja térmica contiene bandejas de 195 frascos de vacuna congelados (6 dosis cada uno). Los viales sin perforar y sin diluir se pueden almacenar en el refrigerador entre +2°C a +8'0 hasta por 1 mes (30 días) Una vez abierta la caja los viales congelados deben introducirse al refrigerador para descongelarlos a una temperatura entre +2°C a +8°C*. Los viales descongelados a temperatura ambiente (hasta 25°C) deben usarse de forma inmediata. Los viales no perforados no se pueden mantener a temperatura ambiente durante más de 2 horas (incluido el tiempo de descongelación) (6). Se debe marcar cada vial con la fecha y hora de descongelación. Use las etiquetas para rastrear el tiempo de almacenamiento a temperaturas refrigeradas y congeladas (6). No vuelva a congelar la vacuna después de descongelada. Use los viales disponibles en el refrigerador antes de sacarlos de la temperatura ultracongelador o del almacenamiento en el congelador. |  |
*Una bandeja completa con 195 viales tarda 3 horas en descongelarse. Los viales Individuales se descongelan en menos tiempo.
Procedimiento para la dilución de la vacuna
Para cada vial de vacuna se recomienda hacer la dilución siguiendo los siguientes pasos:
Tabla 2. Pasos para la dilución de la vacuna contra la COVID-19 laboratorio Pfizer-BioNTech
| Antes de mezclar, verifique las fechas de vencimiento de la vacuna y el diluyente. NUNCA use vacunas o diluyentes vencidos. Las fechas de vencimiento del diluyente y la vacuna se encuentran en el respectivo vial. Permita que el vial alcance la temperatura ambiente y, antes de diluir, invierta suavemente el vial 10 veces, sin agitar ni sacudir (como muestra la figura). Vigile que la vacuna se presente en forma blanquecina sin partículas visibles no blanquecinas. Nota: Ubique la vacuna en cuarentena si hay partículas o decoloración. |   |
| 1. El vial de la vacuna una vez descongelado contiene 0,45 ml y debe diluirse en su vial original con 1,8 ml de solución inyectable de cloruro de sodio 9 mg/ml (0,9%), utilizando una aguja de calibre 21G o más estrecha y técnicas asépticas. Para reconstituir la vacuna el diluyente debe estar a temperatura ambiente o refrigerado a temperaturas entre +2*0 - +8*C. El diluyente NO se debe congelar. Anote la fecha y la hora en que se mezcló la vacuna en el vial. | 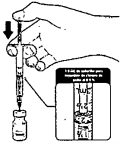 |
2. Una vez coloque todo el diluyente en el vial y antes de retirar la jeringa extraiga 1,8 ml de aire, para equilibrar la presión del frasco y evitar la aerosolización. | 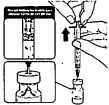 |
| 3. Invertir suavemente la solución diluida 10 veces (como se muestra en la figura). NO sacudir ni agitar.La vacuna diluida debe presentarse como una solución blanquecina sin partículas visibles. Ubique la vacuna en cuarentena si hay partículas o decoloración. |  |
| 4. Los viales diluidos deben marcarse con la fecha y la hora de dilución y almacenarse entre +2°C a +8°C. Usar inmediatamente y dentro de las 6 horas posteriores a la dilución. Nota: Ningún vial podrá usarse 6 horas después de la hora exacta en que se hizo la dilución. |  |
| 5. Después de la dilución, el vial contiene 6 dosis de 0,3 ml. Extraiga la dosis necesaria de 0,3 ml de vacuna diluida con una aguja y una jeringa estériles de 1 ml (22G o 23G) convencional o auto descartable según disponibilidad y deseche cualquier vacuna no utilizada dentro de las 6 horas posteriores a la dilución. Mantenga la vacuna mezclada entre 2°C y 8°C, minimice la exposición a la luz ambiental y evite la exposición a la luz solar directa y ultravioleta, Administrar dentro de las 6 horas. Deseche cualquier vacuna no utilizada después de 6 horas. No vuelva a guardarlo en el congelador (6).No se extraerán fracciones de dosis de un vial para ser completadas con otro vial. Si la cantidad de vacuna que queda en el vial no es suficiente para obtener una dosis completa de 0,3 ml, se desechará el vial con el volumen sobrante. | 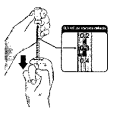 |
Nota: Verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante si es así siga el siguiente flujo de información:
1. Reporte al coordinador del punto de vacunación su hallazgo.
2. No utilice el vial, sepárelo y márquelo como cuarentena.
3. Realice un video del vial, evidenciando su hallazgo.
4. Realice el reporte al coordinador municipal por correo electrónico indicando lote y fabricante y envíe la evidencia.
5. Reporte al nivel municipal y/o departamental/distrital.
6. El nivel departamental/distrital reportará al MSPS por vía telefónica por los teléfonos del CNE para PAL Envíe al correo electrónico establecido por el MSPS.
7. El MSPS informará al Invima, así como al fabricante el reporte de los hallazgos.
8. Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial.
Técnica para aplicar la vacuna
--Realice la higiene de las manos antes de la preparación de la vacuna, entre la atención de pacientes y siempre que se ensucien las manos.
--Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho.
--Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
--Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
--Antes de inyectar la dosis compruebe que la jeringa preparada no está fría al tacto, que contiene el volumen adecuado de 0,3 ml y que el producto no presenta partículas ni anormalidades de color (6).
--Con una mano estire la piel con los dedos pulgar e índice.
--Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90° sobre el plano de la piel.
--Introduzca la aguja por vía intramuscular.
--Presione el émbolo para que penetre la vacuna.
--Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
--Estire la piel para perder la luz del orificio que dejó la aguja.
--Presione por 30 a 60 segundos con la torunda, sin dar masaje. Al concluir el procedimiento, realice la higiene de manos.
Contraindicaciones y precauciones (4)
--Son muy pocas las personas que no pueden recibir el biológico de Pfizer BioNTech.
--Donde hay duda, en lugar de retener vacunación, se debe buscar el asesoramiento adecuado del especialista pertinente o del equipo local de inmunización o protección de la salud.
--La vacuna no debe administrarse a personas que hayan tenido una reacción alérgica sistémica previa de cualquier gravedad (incluida la anafilaxia de inicio inmediato) a:
--Una dosis anterior de la misma vacuna COVID-19
--Cualquier componente (excipiente) de la vacuna COVID-19, p. Ej. Polietilenglicol (PEG)
--Un número muy pequeño de personas ha experimentado anafilaxia cuando se vacunó con el Vacuna Pfizer BioNTech. Tras una estrecha vigilancia nacional, la MHRA ya no aconseja que las personas con antecedentes de anafilaxia a cualquier vacuna, medicamento o alimento no reciban la vacuna. Cualquier persona con antecedentes de reacciones alérgicas a los componentes de la vacuna no debe recibirla, pero aquellos con cualquier otra alergia (como una alergia alimentaria) pueden recibir la vacuna.
--La vacuna de ARNm de Pfizer BioNTech contiene PEG. El PEG (también conocido como macrogoles) son un grupo de alérgenos conocidos que se encuentran comúnmente en medicamentos, muchos productos para el hogar y cosmética. Los medicamentos que contienen PEG incluyen algunas tabletas, laxantes, inyecciones de esferoides de depósito y algunas preparaciones intestinales que se usan para (a colonoscopia.
--La alergia conocida a la PEG es rara, pero contraindicaría la recepción de esta vacuna. (Sellaturay P et al, 2020). No está claro si el PEG es la única causa de reacciones alérgicas en pacientes con síntomas alérgicos sistémicos después de la primera dosis de la vacuna Pfizer-BioNTech
En estos casos, tras recibir la vacunación también se mantendrá un seguimiento de 15 o 30 minutos. Ver resumen (Tabla 3).
Tabla 3. Manejo de pacientes con historia de alergia
| Continuar con la vacunación | Precauciones especiales | Vacunación contraindicada | |
| Características del paciente | Reacción alérgica previa (incluida la anafilaxia) a un alimento, picadura de insecto y la mayoría de los medicamentos (donde se ha identificado el desencadenante) --Antecedentes familiares de alergias --Reacción no sistémica a una vacune anterior --Hipersensibilidad a fármacos antiinflamatorios no esteroideos, p. Ej aspirina, ibuprofeno --Mastocitosis | Antecedentes de anafilaxia inmediata a múltiples clases de fármacos diferentes, sin identificar el desencadenante (esto puede indicar alergia a la PEG) --Antecedentes de anafilaxia a uní vacuna, anticuerpos inyectados o un medicamento que probablemente contenga PEG (por ejemplo inyección de esferoides de depósito laxante) --Antecedentes de anafilaxia idiopática | --Reacción alérgica sistémica previa a la vacuna COVID-19 --Para una vacuna COVID-19 basada en ARNm, reacción alérgica previa a otra vacuna de ARNm. --Reacción alérgica previa a un componente de la vacuna, incluido el PEG. |
| Acciones | --Proceder con la vacunación normal, de acuerdo con las pautas locales | --Discutir con un especialista en alergias y considerar la posibilidad de alergia al PEG--Considere la observación durante 30 minutos si procede la vacunación (consulte las precauciones-- Algunos pacientes pueden beneficiarse del tratamiento previo con antihistamínicos, sin embargo esto puede enmascarar los síntomas iniciales de una reacción | --No administre la vacuna en cuestión, consulte con un alergólogo o su médico tratante. |
Tomado de: COVID-19: The green book, chapter 14' (4).
Precauciones
Se han informado reacciones anafilácticas después de la administración de la vacuna BNTie2t2 fuera de los ensayos clínicos.
--Riesgo de reacciones alérgicas agudas.
--Una historia de cualquier reacción alérgica inmediata a cualquier otra vacuna o terapia inyectable (intramuscular o intravenosa o vacunas intramusculares o subcutáneas) se considera una precaución, pero no una contraindicación para la vacunación.
--A estas personas, se les debe realizar una evaluación de riesgo para determinar el tipo y la gravedad de la reacción y la fiabilidad de la información; pueden recibir vacunación, pero se les debe informar la posibilidad de desarrollar una reacción alérgica, sopesando los riesgos contra los beneficios de la vacunación.
--Se recomienda la observación de las personas durante 30 minutos después de la vacunación.
--Dado que también se ha notificado un pequeño número de reacciones anafilácticas en vacunados sin antecedentes de reacciones alérgicas graves, la OMS recomienda que la vacuna se administre solo en entornos donde se pueda tratar la anafilaxia.
--Hasta que no haya más datos e información disponible con respecto a reacciones alérgicas a la vacunación con BNT162b2, se recomienda observar durante al menos 15 minutos a todos los vacunados.
--Las personas con antecedentes de enfermedad alérgica: de contacto (látex), alimentaria (huevo, gelatina, leche, frutas), respiratoria incluida el asma controlada y la rinitis, alergia a mascotas, a otros medicamentos, pueden vacunarse en los centros de vacunación dispuestos siguiendo los protocolos establecidos y el tiempo mínimo de espera en el centro de vacunación de 15 minutos inmediato a la aplicación. La enfermedad leve sin fiebre o malestar sistémico no debe posponer la vacunación.
--Si una persona se encuentra muy mal, la vacunación puede posponerse hasta que se haya recuperado por completo. Esto es para evitar confundir el diagnóstico diferencial de cualquier enfermedad aguda (incluido COVID-19) al atribuir erróneamente cualquier signo o síntoma a los efectos adversos de la vacuna.
--No hay evidencia de ningún problema de seguridad al vacunar a personas con antecedentes de infección por COVID-19 o con anticuerpos COVID-19 detectadles. ¦
--Es poco probable que la vacunación de personas que puedan estar infectadas o que estén incubando la infección por COVID-19 tenga un efecto perjudicial sobre la enfermedad, en estos casos la vacunación debe posponerse para evitar confundir el diagnóstico diferencial hasta 90 días después de la fecha de inicio de síntomas en personas sintomáticas y por lo menos noventa días (90) contados desde la fecha de toma de muestra para personas asintomáticas.
--Tener síntomas de COVID-19 prolongados no es una contraindicación para recibir la vacuna COVID-19, pero si el paciente está gravemente debilitado, aún se encuentra bajo investigación activa o tiene evidencia de deterioro reciente, se puede considerar el aplazamiento de la vacunación para evitar la atribución incorrecta de cualquier cambio en la condición subyacente de la persona a la vacuna.
--Deberá disponerse del tratamiento médico adecuado para el manejo de las reacciones alérgicas inmediatas en caso de que se produzca una reacción anafiláctica aguda tras la administración de la vacuna COVID-19 de Pfizer-BioNTech.
--Deberá disponerse del tratamiento médico adecuado para el manejo de las reacciones alérgicas inmediatas en caso de que se produzca una reacción anafiláctica aguda tras la administración de la vacuna COVID-19 de Pfizer-BioNTech.
--Tener precaución con pacientes con antecedentes de reacciones alérgicas severas de tipo anafilaxia o angioedema.
--Monitorear a los destinarios <sic> de la vacuna COVID-19 de Pfizer-BioNTech por la ocurrencia de reacciones adversas inmediatas de acuerdo con las directrices del Ministerio de Salud y Protección Social.
--Alteración de la inmunocompetencia. Las personas inmunocomprometidas, incluyendo individuos que reciben tratamiento inmunosupresor, pueden tener una respuesta inmune disminuida a la vacuna COVID-19 de Pfizer-BioNTech.
--Limitación de la eficacia. La vacuna COVID-19 de Pfizer-BioNTech puede no proteger a todos los vacunados.
Advertencias
--Cualquier persona con una enfermedad febril aguda (temperatura corporal superior a 38,5 °C) debe posponer la vacunación hasta que esté afebril.
--Antes de vacunar lea cuidadosamente el inserto o indicación para prescribir que trae adjunto cada una de las vacunas.
--Como sucede con otras inyecciones intramusculares, la vacuna debe administrarse con precaución a las personas que reciban tratamiento anticoagulante o a aquellas que presenten trombocitopenia o padezcan un trastorno de la coagulación (como hemofilia) debido a que en estas personas se puede producir sangrado o formación de hematomas tras una administración intramuscular.
--Las personas inmunodeprimidas, incluidas las personas que reciben terapia inmunosupresora, pueden tener una respuesta inmunitaria disminuida a la vacuna. No hay datos disponibles sobre el uso concomitante con inmunosupresores.
--Como con cualquier vacuna, la vacunación con la vacuna BNT162b2 puede no proteger a todos los receptores de la vacuna.
--No se dispone de datos sobre el uso de la vacuna de BNT162b2 en personas que hayan recibido previamente una serie de vacunas completa o parcial con otra vacuna de COVID-19.
--Información sobre el excipiente: Esta vacuna contiene potasio, menos de 1 mmol (39 mg) por dosis, es decir, esencialmente “libre de potasio". Esta vacuna contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, esencialmente “libre de sodio”.
--La vacuna no se debe aplicar en personas que recientemente hayan presentado COVID-19 y aun no se recuperen.
--Personas con inmunosupresión severa por cualquier causa (incluye personas con VIH no controlado), pueden vacunarse, aunque la respuesta inmunológica por su estado podría no garantizar la eficacia demostrada de la vacuna
--Las personas con antecedente de COVID-19 confirmado, en el marco del PNV contra la COVID-19 serán vacunadas noventa (90) días contados después de inicio de síntomas en personas sintomáticas o a partir de la toma de muestra en personas asintomáticas.
Fertilidad, embarazo y lactancia
--Embarazo: Ver Consideraciones respecto a la vacunación de gestantes ítem 1.1.3 del Anexo 1.
--Lactancia: Se espera que la eficacia de la vacuna sea similar en mujeres lactantes que en otros adultos. Como la vacuna BNT162b2 no es de virus vivo y el ARNm no ingresa al núcleo de la célula y se degrada rápidamente en el citoplasma de las células, es biológica y clínicamente poco probable que represente un riesgo para el niño que amamanta. Sobre la base de estas consideraciones, una mujer lactando, que forma parte de un grupo recomendado para la vacunación, por ejemplo, a los trabajadores de la salud, se les debe ofrecer la vacunación sopesando riesgo beneficio.
La OMS recomienda continuar con la lactancia materna después de la vacunación ver: https://www.who.int/news-room/events/detail/2021/01/05/default-calendar/extraordinary-meeting-of-the-strategic-advisory-group-of-experts-on-iminunization-(sage)–5-january-2021
--Fertilidad: Están en curso los estudios de toxicidad reproductiva en líneas de investigación en animales.
Reacciones adversas esperadas
En los estudios clínicos, las reacciones adversas en los participantes a partir de los 16 años y mayores incluyen dolor en el lugar de la inyección (84,1%), fatiga (62,9%), cefalea (55,1%), dolor muscular (38,3%), escalofríos (31,9%), dolor articular (23,6%), fiebre (14,2%), inflamación en el lugar de la inyección (10,5%), enrojecimiento en el lugar de la inyección (9,5%), náuseas (1.1%), malestar general (0.5%) y linfadenopatía (0,3%).
En un estudio clínico, las reacciones adversas en adolescentes de 12 a 15 años incluyeron dolor en el lugar de la inyección (90,5%), fatiga (77,5%), cefalea (75,5%), escalofríos (49,2%), dolor muscular (42,2%), fiebre (24,3%), dolor articular (20,2%), inflamación en el lugar de la inyección (9,2%), enrojecimiento del lugar de la inyección (8,6%), linfadenopatía (0,8%) y náuseas (0,4%).
Se han reportado reacciones alérgicas graves tras la administración de la vacuna COVID-19 de Pfizer-BioNTech durante la vacunación en masa fuera de los estudios clínicos. La información de experiencia en estudios clínicos puede ser consultada en la Información para prescribir (IPP).
En caso de sobredosis
Los participantes que recibieron 58 microgramos de la vacuna BNTi62t>2en ensayos clínicos no informaron un aumento en la reactogenicidad o eventos adversos.
En caso de sobredosis: >0,3 ml se recomienda la monitorización de las funciones vitales y el posible tratamiento sintomático.
Interacción con otros medicamentos y otras formas de interacción
--No se han realizado estudios de interacción. No se ha estudiado la administración concomitante de la vacuna de BNT162b2 con otras vacunas.
--No mezclar la vacuna BNT162b2 con otras vacunas / productos en la misma jeringa.
Efectos sobre la capacidad para conducir y utilizar máquinas
La vacuna BNT162b2 tiene una influencia nula o insignificante sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunas de las reacciones adversas pueden afectar temporalmente a la capacidad para conducir o utilizar máquinas.
Vacunación segura
Antes de recibirla vacuna BNT162b2 debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo si usted:
--Tiene alguna alergia. Es importante indagar al usuario sobre su historial alérgico (Center for Disease Control and Prevention (CDC). Morbidity and Mortality Weekly Report (MMWR) Allergic Reactions Including).
--Tiene fiebre.
--Tiene un trastorno hemorrágico o está tomando un anticoagulante.
--Está inmunocomprometido o está tomando un medicamento que afecta a su sistema inmunológico.
--Ha recibido otra vacuna contra la COVID-19.
--En caso de ser mujer en edad reproductiva preguntar:
--Está embarazada o planea quedar embarazada
--Está amamantando
--Si el usuario solicita su segunda dosis: verifique el carné de vacunación. Si no lo trae, proceda a verificar en el PAIWEB el tipo de vacuna que se aplicó en su primera dosis, antes de pasarlo al paso de ruta de la aplicación de la vacuna.
(Hoja informativa para receptores y proveedores de cuidado autorización de uso de emergencia (EUA, por sus siglas en inglés) de la vacuna contra la COVID-19 de Pfizer-BioNTech para prevenir la enfermedad del coronavirus 2019 (COVID-19) en personas de 16 años y mayores. https://www.in.gov/isdh/files/Recipient Fact Sheet Spanish.pdf)
Nota: Ver ítem contraindicaciones.
Fuentes de información
1. Public Health England. COVID-19 vaccination guidance for Healthcare practitioners. [Internet]. Última actualización: 31 de diciembre de 2020. [cited 2021 Apr 10], Available from:
https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/965t77/COVID-19_vaccination_programme_guidance_for_healthcare_workers_26_February_2021_v3-4.pdf
2. Invima. Resolución 2021000183 del 5 de enero de 2021. Por la cual se otroga<sic> la ASUE para la vacuna Pfizer BioNTech Covid-19 vaccine. 2021;
3. Ministerio de la Protección Social. Resolución 419. 2022; Available from:
https://www.minsalud.gov.co/Normatividad_Nuevo/Resolucion No. 419 de 2022.pdf
4.COVID-19: the green book chapter 14a. Coronavirus (COVID-19) vaccination Information for public health professionals. Public Health England.
r. Centers for Disease Control Prevention. Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States [Internet]. 2021 [cited 2021 Jan 18], Available from: https://www.cdc.gov/vaccines/covid-19/info-by-product/clinical-considerations.html?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fvaccines%2Fcovid-19%2Finfo-by- product%2Fpfizer%2Fclinical-considerations.html#Administration
6. CDC. 20 de mayo. Pfizer-BioNTech COVID-19 Vaccine. Vaccine Preparation and Administration Summary [Internet]. 2021. Available from: https://www.cdc.gov/vaccines/covid-19/info-by-product/pfizer/downloads/prep-and- admin-summary.pdf
7.Instituto Nacional de Salud-Grupo de enfermedades transmisibles. Farmacovigilancia de vacunas. (Evento adverso posterior a la vacunación). Código: 298 Equipo de Inmunoprevenibles. [Internet], 2021. Available from: https://www.ins.gov.co/buscador-eventos/Lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf
ANEXO TÉCNICO PARA LA APLICACIÓN DE LA VACUNA CORONAVAC DE SINOVAC BIOTECH CONTRA LA COVID-19.
Generalidades
La vacuna contra la COVID-19 denominada CoronaVac de SinoVac, forma parte del grupo de vacunas inactivadas. Está compuesta por la cepa CZ02 del virus SARS-CoV-2, cultivada en Células Vero, donde es incubada y posteriormente extraída e inactivada para evitar su replicación. Luego es concentrada, purificada y adsorbida en hidróxido de aluminio, el cual actúa como un agente adyuvante, para inducir la respuesta inmune (1).
Debido a que el virus completo se presenta al sistema inmunológico, es probable que las respuestas inmunitarias se dirijan no solo a la proteína S (espícula) del SARS-CoV-2, sino también a la matriz, la envoltura y la nucleoproteína (2).
Presentación, forma farmacéutica e indicación terapéutica
Presentación:
--Monodosis: Cala con 40 viales de 0.5 ml
Vial de 2 dosis: Caja con 40 viales. Cada vial contiene 1.0 ml, 2 dosis por vial. Una dosis corresponde a 0.5ml (3).
Cada dosis de 0,5 ml de suspensión inyectable contiene 600 SU del SARS-CoV inactivado (antígeno viral).
Forma farmacéutica: Concentrado dispersión inyectable. La vacuna es una suspensión opalescente. Puede formar un precipitado estratificado que se puede dispersar mediante una suave homogenización.
Indicaciones terapéuticas: La vacuna está indicada para la inmunización activa para prevenir casos de la enfermedad causada por el virus SARS-CoV-2, en personas de 3 años o más que son susceptibles.
Conservación
--La vacuna CoronaVac de SinoVac debe almacenarse entre +2 °C a +8 DC, protegida de la luz.
--No congelar.
Periodo de validez (3,4)
Monodosis:
--Vial sin abrir: Puede conservarse hasta 36 meses entre +2 °C a +8 °C.
--Vial abierto: Uso inmediato.
Vial de 2 dosis:
--Vial sin abrir: Puede conservarse hasta 24 meses entre +2 °C a +8 °C.
Vial abierto: Se ha demostrado la estabilidad química y física en uso desde el momento de la apertura del vial hasta 8 horas en refrigeración (2°Ca 8 °C).
Eficacia (5,6)
--Estudios de seguridad e inmunigenecidad. Los realizados en China incluyeron adultos sanos de 18-59 años (fase 1=144 y fase 2=600), con diferentes esquemas de vacunación 0/14, 0/28, 0/28/56 días. También se incluyeron adultos sanos >60 años (fase 1=72 y Fase 2=350) con esquema de 0/14 días. Los análisis en Chile con 2300 participantes sanos >18 años, con esquema de 0/14 y 0/28 días. Para estos dos estudios aún están pendientes los informes de eficacia reportes.
--El estudio de Fase III realizado en China incluyó 1040 adultos >18 años de los cuales el 25% fueron >60 años con un esquema 0/14 días.
--Estudios de eficacia y de consistencia de lote. En Indonesia 1620 participantes sanos con esquema 0/14 días con una protección en sintomáticos del 65% (IC: 20%-85%). Turquía, 13000 participantes sanos de 18 a 59 años, esquema 0/14 mostró un 84% de eficacia en enfermedad sintomática y 100% de protección ante hospitalización. Por su parte en Brasil realizado en 12688 personas sanas >18 años (trabajadores de la salud que trataban pacientes con COVID-19), la protección en sintomáticos fue de 51% mientras que la protección contra hospitalización fue del 100%.
--La eficacia de esta vacuna se ha demostrado en un esquema de 2 dosis con un intervalo de 28 días. La eficacia fue del (50,39%), para la prevención de casos sintomáticos de COVID-19 (7). Para la prevención de casos sintomáticos de COVID-19 que requirieron asistencia ambulatoria u hospitalaria, la eficacia fue del 77,96% (4).
--En el estudio realizado por el Instituto Buntantan de Brasil, la vacuna parece tener un efecto general de disminuir la intensidad de la enfermedad causada por SARS-CoV-2 (8,9).
| Lugar | Tamaño de población | Esquema (días) | Diseño y medida del efecto | Circulación de VOCs | Protección contra sintomáticos | Protección contra hospitalización |
| Turquía | 13.000 | 0-14 | RCT/Eficacia | Limitada | 84% (65,92) | 100% (20,100) |
| Indonesia | 1.620 | 0-14 | RCT/Eficacia | Limitada | 65% (20,85) | No estimada* |
| Brasil | 12.688 | 0-14 | RCT/Eficacia | Limitada | 51%(36X2) | 100%(56,100) |
| * Ningún caso hospitalizado**Análisis basado en quienes recibieron >1 dosis | VOCs=Variantes preocupantesTND=Diseño de prueba negativa (Test Negative Design) | |||||
Efectividad (5,6)
Estudios de efectividad. En Chile donde se incluyeron 10.5 millones de personas >18 años con un esquema de 0/28 días mostró 14 días después de la segunda dosis una efectividad para prevenir la COVID-19 sintomática del 67% (IC= 65-69%); prevenir la hospitalización en el 85% (IC= 83-87%); prevención de admisión en UCI 89% (IC= 84-92%) y la muerte en el 80% (IC= 73-86%). Además, estos ensayos se realizaron con la presencia de las variantes de interés P.1 y B. 1.1.7.
En los estudios realizados en Brasil a 393 personas en un análisis de casos y controles pareados reportó un 50% de efectividad frente a la enfermedad sintomática con la presencia de la variante de interés P.1 (9).
| Lugar | Tamaño de población | Esquema (días) | Diseño y medida del efecto | Circulación de VOCs | Protección contra sintomáticos | Protección contra hospitalización |
| Chile | 10.5 millones | 0-28 | Cohorte / Efectividad | P.1, B.l.1.7 | 67% (65,69) | 85% (83, 97) |
| Brasil | 393 casos y controles pareados | 1-14** | TDT/ Efectividad | P.1 | 50% (11.71) | No reportada |
| * Ningún caso hospitalizado **Análisis basado en quienes recibieron >1 dosis | VOCs=Variantes preocupantes TND=Diseño de prueba negativa (Test Negative Design) | |||||
Dosis, vía, y sitio de administración
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1a dosis(Considérese día 0) | 0,5 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos que poralguna |
| 2a dosis(28 días después de aplicada la primera dosis) | situación particular se requiera aplicar en el brazo derecho. | ||
Nota: No inyectar la vacuna por vía intravascular, subcutánea o intradérmica
Preparación de la vacuna
--Homogenice la vacuna con movimientos circulares suaves (4)
--No mezcle en la misma jeringa con otras vacunas.
--La vacuna está lista para usarse después de abierta.
--No congelar, ni diluir
--No utilice la vacuna si el frasco está roto, mal rotulado o si hay material extraño en la solución.
Nota: Verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante, si es así siga el siguiente flujo de información:
1. Reportar al coordinador del punto de vacunación su hallazgo.
2. No utilizar el vial, sepárelo y márquelo como cuarentena.
3. Realice un video del vial, evidenciando su hallazgo.
4. Realice el reporte al coordinador municipal, por correo electrónico indicando lote y fabricante y envíe la evidencia.
5. Reporte al nivel municipal y/o departamental/distrital.
6. El nivel departamental/distrital reportará a este Ministerio vía telefónica a través de los teléfonos del CNE para PAI y enviará el reporte a través del correo electrónico establecido para tal fin.
7. El Ministerio de Salud y Protección Social informará al Invima, así como al fabricante el reporte de los hallazgos.
8. Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial.
Administración
--No se debe programar que las personas reciban la segunda dosis antes 28 días recomendados.
--Inicialmente realice higiene de manos.
--Verifique el volumen de la dosis:
Monodosis: contiene 0,5 ml de suspensión.
Vial 2 dosis: El vial de 1ml de volumen contiene dos (2) dosis cada una de 0.5 ml.
--Confirme que no hay partículas y que no se observa decoloración. Ubique la vacuna en cuarentena si hay partículas o decoloración.
--Extraiga la dosis necesaria de 0,5 ml de vacuna con una aguja y una jeringa estériles de 1 ml (22G o 23G) convencional o auto descartable según disponibilidad.
Técnica para aplicar la vacuna
--Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho.
--Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
--Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
--Con una mano estire la piel con los dedos pulgar e índice.
--Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90° sobre el plano de la piel.
--Introduzca la aguja por vía intramuscular.
--Presione el émbolo para que penetre la vacuna.
--Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
--Estire la piel para perder la luz del orificio que dejó la aguja.
--Presione por 30 a 60 segundos con la torunda, sin dar masaje.
--Elimine los desechos en los contenedores de residuos especiales.
--Al concluir el procedimiento, realice la higiene de manos.
Coadministración con otras vacunas (6)
--La serie de vacunas CoronaVac de SinoVac debe administrarse de forma rutinaria sola, hasta que se disponga de datos sobre la seguridad y eficacia de la vacuna coadministrada con otras vacunas.
--No se han realizado estudios clínicos sobre el efecto pre, post o simultaneo de otras vacunas sobre la inmunogenicidad de CoronaVac.
--Debido a que no se cuenta con estudios de coadministración para este biológico y teniendo en cuenta que la OMS (10), recomienda para otras vacunas fabricadas en diferentes plataformas que el intervalo entre la administración de esta vacuna y las diferentes vacunas del PAI, mínimo 14 días.
Observación post-vacunación
Durante el estudio clínico no se presentaron reacciones alérgicas graves; sin embargo, debido a algunas reacciones alérgicas presentadas posterior al inicio de la vacunación, el fabricante recomienda que las personas vacunadas permanezcan en observación. Se debe informar al usuario de las posibles reacciones adversas y cuales deben ser las conductas en caso de presentarse.
Contraindicaciones
--No administre la vacuna CoronaVac de SinoVac a personas con antecedentes conocidos de alergia a algún componente de la vacuna. Un historial de anafilaxia a cualquier componente de la vacuna es una contraindicación para la vacunación (6).
--Contraindicación transitoria: en pacientes con cuadro febril agudo.
Precauciones
--Un historial de anafilaxia a cualquier otra vacuna o terapia inyectable (es decir, vacunas o terapias intramusculares, intravenosas o subcutáneas) se considera una precaución, pero no una contraindicación para la vacunación. Para estas personas, un profesional de la salud con experiencia especializada en trastornos alérgicos debe realizar una evaluación de riesgos. Estas personas aún pueden recibir la vacuna. Aún es incierto si existe un mayor riesgo de anafilaxia, pero deben ser asesorados sobre el riesgo potencial de anafilaxia y los riesgos deben sopesarse con los beneficios de la vacunación.
--Las personas con una reacción alérgica no anafiláctica inmediata (se define-como cualquier signo o síntoma: urticaria, angioedema o síntomas respiratorios sin ningún otro síntoma (tos, sibilancias, estridor), que se presente dentro de las 4 horas posteriores a la administración) a la primera dosis no deben recibir dosis adicionales, a menos que se recomiende después de una revisión por parte de un profesional de la salud con experiencia especializada.
--La vacunación se debe posponer en personas que presenten una enfermedad febril aguda grave o una infección aguda.
Vacunación de poblaciones específicas (6)
Poblaciones para las que existen datos limitados o nulos
Adultos mayores de 60 años
Los recientes datos de observaciones preliminares posteriores a la introducción de Chile sugirieron una efectividad constante de la vacuna en todos los grupos de edad. En personas de 60 años o más, la efectividad de la vacuna a partir de 14 días después de la dosis 2 fue de 67,4 (IC del 95%: 64,6- 69,6%) dosis contra la infección sintomática por SARS-CoV-2, 83,3% (IC 95% 80,4-85,8%) frente a hospitalizaciones y 83% (IC 95%: 76,4-87,7%) frente a muerte. Estos datos de observación, junto con los resultados de inmunogenicidad, sugieren que es probable que Sinovac-CoronaVac tenga un efecto protector en las personas mayores, aunque si a un nivel equivalente al de los adultos más jóvenes queda por demostrar en estudios posteriores.
Si bien los datos sobre la seguridad de las vacunas del ensayo clínico de fase 3 son muy limitados, no hay razones teóricas para creer que la vacuna tiene un perfil de seguridad diferente en los adultos mayores que en los adultos más jóvenes para los que existe evidencia específica de esta vacuna.
Los datos de ensayos y posteriores a la introducción disponibles actualmente indican que la vacuna es segura en adultos mayores.
El riesgo de enfermedad grave y muerte por COVID-19 aumenta considerablemente con la edad. Los adultos mayores se identifican como un grupo prioritario en la Hoja de ruta de priorización del SAGE de la OMS. Sobre la base de toda la evidencia actualmente disponible, la OMS recomienda la vacuna para su uso en personas de 60 años o más. Para hacer esta recomendación más sólida y basada en evidencia, se deben generar datos adicionales sobre la seguridad y eficacia de la vacuna en este grupo de edad.
Personas con comorbilidades
Se han identificado ciertas comorbilidades que aumentan el riesgo de enfermedad grave por COVID- 19 y muerte. La eficacia de la vacuna fue demostrada entre los participantes con obesidad y los que tenían hipertensión; el número de participantes con otras comorbilidades eran demasiado pequeño para poder extraer conclusiones firmes. Teniendo en cuenta la evaluación beneficio-riesgo favorable, la vacunación es recomendada para personas con comorbilidades que se han identificado como un aumento del riesgo de COVID-19 grave.
Mujeres embarazadas y lactancia
La evidencia sugiere que las mujeres embarazadas con COVID-19 tienen un mayor riesgo de desarrollar una enfermedad grave en comparación con las no embarazadas en edad reproductiva. También se ha asociado con un mayor riesgo de parto prematuro y de recién nacidos que requieren cuidados intensivos. Mujeres embarazadas que tienen 35 años o más, o que tienen un índice de masa corporal alto o una comorbilidad, como la diabetes o la hipertensión, tienen un riesgo particular de resultados graves por COVID-19.
Los datos disponibles sobre Sinovac-CoronaVac en mujeres embarazadas son insuficientes para evaluar la eficacia de la vacuna o los riesgos asociados a la vacuna en el embarazo. Sin embargo, los estudios de toxicología del desarrollo y la reproducción (DART) en animales no han mostrado efectos nocivos en el embarazo. Además, esta vacuna es una vacuna inactivada con un adyuvante que se usa habitualmente en muchas otras vacunas con un buen perfil de seguridad documentado, incluso en mujeres embarazadas. Sobre la base de la experiencia previa con el uso de otras vacunas inactivadas utilizadas durante el embarazo, se espera que la eficacia de Sinovac-CoronaVac en mujeres embarazadas sea comparable a la observada en mujeres no embarazadas de edad similar. Se deben realizar estudios para evaluar la seguridad y la inmunogenicidad en mujeres embarazadas.
Mientras tanto, la OMS recomienda el uso de Sinovac-CoronaVac en mujeres embarazadas cuando los beneficios de la vacunación superan los riesgos potenciales. Para ayudar a las mujeres embarazadas a realizar esta evaluación, se les debe proporcionar información sobre los riesgos de COVID-19 en el embarazo, los probables beneficios de la vacunación en el contexto epidemiológico local, y las limitaciones actuales de los datos de seguridad en mujeres embarazadas.
Un número limitado de mujeres embarazadas se han vacunado inadvertidamente, las cuales se encuentran en seguimiento de seguridad, los ensayos clínicos están en curso.
Aunque las vacunas inactivadas no están contraindicadas en el embarazo, y no se observó toxicidad ni teratogenicidad en modelos animales, CoronaVac no debe ser usada en mujeres embarazadas, ya que faltan estudios que avalen su seguridad en esta población.
Se espera que la eficacia de la vacuna sea similar en mujeres lactantes que en otros adultos. Sin embargo, no existen datos sobre la seguridad de las vacunas COVID-19 en mujeres lactantes o sobre los efectos de esta vacuna en niños amamantados. Como CoronaVac es una vacuna inactivada y no es de virus vivo, es biológica y clínicamente poco probable que represente un riesgo para el niño que amamanta.
Advertencias y precauciones especiales de empleo
Trazabilidad
Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
--Antes de vacunar lea cuidadosamente el inserto o indicación para prescribir que trae adjunto cada una de las vacunas.
--Se debe disponer de epinefrina, de otros medicamentos y dispositivos médicos para el control inmediato de una eventual reacción alérgica seria.
--Bajo ciertas circunstancias, el uso de esta vacuna debe ser cuidadosamente utilizada:
-La inyección intramuscular de esta vacuna en pacientes con trombocitopenia o trastornos hemorrágicos puede causar hemorragia.
-La respuesta inmune de la vacuna puede verse reducida en pacientes que han recibido terapia inmunosupresora o que tengan inmunodeficiencia.
-La vacunación debe recomendarse para pacientes con deficiencia inmune crónica, aun cuando su enfermedad de base pueda limitar la respuesta inmunológica.
-En pacientes con epilepsia no controlada u otros trastornos neurológicos, como Síndrome de Guillain-Barre.
--Como cualquier vacuna, la inmunización con este producto puede no proteger al 100% de los individuos.
--No utilizar si el vial está quebrado, no cuenta con los sellos de seguridad de producto, o no presenta la etiqueta autoadhesiva con el número de la Resolución que autoriza su importación, o si se ve alguna partícula extraña dentro del vial.
--No combine este producto con otras vacunas en la misma jeringa.
--No congelar. Una vez abierta, la vacuna debe ser usada inmediatamente.
--Se desconoce la duración de la protección proporcionada por la vacuna, ya que todavía se está determinando en ensayos clínicos en curso.
--Información sobre el excipiente: hidróxido de aluminio, hidrogenofosfato de disodio, dihidrogenofosfato de sodio, cloruro de sodio, agua para preparaciones inyectables e hidróxido de sodio para ajustar el pH.
Este producto no contiene conservantes.
Reacciones adversas esperadas
--No hubo ninguna reacción adversa grave relacionada a la vacuna después de 28 días desde la administración de la segunda dosis.
--Reacciones locales: Dolor en sitio de inyección, eritema, edema, endurecimiento de la zona de inyección y prurito.
Reacciones sistémicas: Cefalea, fatiga, mialgias, náuseas, diarrea, artralgia, tos, escalofríos, disminución de apetito, vómito, exantema, reacción alérgica y fiebre.
Resumen de seguridad clínica (5)
--De los 8.840 participantes que recibieron la vacuna Sinovac, el 94% recibió la dosis / esquema autorizado, presentaron eventos adversos leves / moderados. Los más comunes fueron dolor en el lugar de la inyección, dolor de cabeza, fatiga y mialgia.
--En los ensayos de fase 3 en Brasil no hubo desequilibrio de eventos adversos entre los vacunados y el grupo placebo. Todos los eventos adversos fueron clasificados como "improbables" o "no relacionados" con la vacunación. Hubo 3 muertes en el ensayo: 2 en el grupo placebo (COVID-19 y paro cardiopulmonar) y 1 en el grupo de la vacuna (suicidio). Pocas reacciones alérgicas, todas de grado 1 o 2.
Resumen de seguridad posterior a la autorización (5)
Hasta la fecha, no se han identificado señales inesperadas de la vigilancia pasiva posterior a la autorización, aunque se limitan a datos de China, Indonesia, Brasil y Chile.
--China: Basado en 35,8 millones de dosis distribuidas y 49 eventos adversos graves notificados, que incluyen anafilaxia, púrpura de Henoch-Schonlein, edema laríngeo, desmielinización, hemorragia cerebral (n<6).
Brasil / Indonesia: Aproximadamente 17 millones de dosis distribuidas y 162 eventos adversos graves notificados, que incluyen fiebre, disnea, dolor de cabeza y muerte (n<16).
Chile: Basado en 3,7 millones de dosis distribuidas y 90 eventos adversos graves notificados. Los más comunes fueron los síntomas clínicos de anafilaxia, con una tasa de notificación de 1.7 /100,000 dosis, menor que la reportada para otra vacuna COVID-19.
Interacción con otros medicamentos y otras formas de interacción (12)
--No se han realizado estudios de interacción. No se ha estudiado la administración concomitante de la vacuna de CoronaVac de SinoVac con otras vacunas.
--No mezclar la vacuna CoronaVac de SinoVac con otras vacunas / productos en la misma jeringa.
--Fármacos inmunosupresores, quimioterapia, antimetabolitos, agentes alquilantes, fármacos citotóxicos, corticoides, entre otros, pueden reducir la respuesta inmune del organismo a esta vacuna.
--Pacientes que están recibiendo tratamiento: para aquellos pacientes que están utilizando fármacos, se recomienda consultar a su médico antes de recibir la vacuna, para evitar posibles interacciones.
Vacunación segura
Antes de recibir la vacuna CoronaVac de SinoVac debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo si:
--Ha tenido previamente una reacción alérgica grave, potencialmente mortal después de cualquier otra vacuna o después de haber recibido CoronaVac.de SinoVac en el pasado.
--Tiene un sistema inmunitario muy débil o deteriorado; está inmunocomprometido o está tomando un medicamento que afecta a su sistema inmunológico
--Se ha desmayado alguna vez tras cualquier inyección de aguja
--Tiene algún trastorno hemorrágico o está tomando un anticoagulante
--Tiene fiebre alta o una infección grave; no obstante, puede ser vacunado si tiene fiebre leve o una infección de las vías respiratorias altas como un resfriado
--Tiene alguna enfermedad grave
--Tiene ansiedad relacionada con las inyecciones
--Tiene fiebre
--Ha recibido otra vacuna contra la COVID-19
--En caso de ser mujer en edad reproductiva preguntar:
-Está embarazada o planea quedar embarazada
-Está amamantando
--Si el usuario solicita su segunda dosis: verifique el carné de vacunación. Si no lo trae, proceda a verificar en el PAIWEB el tipo de vacuna que se aplicó en su primera dosis, antes de pasarlo al paso de ruta de la aplicación de la vacuna.
Nota: Ver ítem contraindicaciones.
Fuente de información
1. Pruâ BM. Current State of the first covid-19 vaccines. Vaccines. 2021;9(1): 1-12.
2. Krammer F. SARS-CoV-2 vaccines in development. Nature [Internet], 2020;586(7830):516-27. Available from: http://dx.doi.org/10.1038/s41586-020-2798-3
3. SinoVac_CoronaVac. Covid-19 Vacine (Vero Cell), Inactivate.
4. Brasil. Ministerio da Saúde. Segundo Informe Técnico: Plano Nacional de Operacionaliza?áo da Vacina?áo contra a Covid-19. 2021;1-45.
5. World Health Organization (WHO). Evidence Assessment: Sinovac/CoronaVac COVID-19 vaccine. For recommendation by the Strategic Advisory Group of Experts (SAGE) on inmunization prepared by the SAGE Working Group on COVID-19 vaccines. 2021.
World Health Organization Strategic Advisory Group of Experts on immunization (SAGE) Working Group on COVID-19 Vaccines. Interim recommendations for use of the inactivated COVID-19 vaccine, CoronaVac, developed by Sinovac. 2021;(May 24):1–7. Available from: https://apps.who.int/iris/bitstream/handle/10665/341454/WHO-2019-nCoV-vaccines-SAGE- recommendation-Sinovac-CoronaVac-2021.1-eng.pdf
7. Faria E De, Guedes AR, Oliveira MS, Godoy MV De, Mala FL, Barboza S, et al. Performance of vaccination with CoronaVac in a cohort of healthcare workers (HCW) - preliminary report. medRxiv - BMJ-YAle [Internet], 2021;1-13. Available from: https://www. medrxiv.org/content/10.1101 /2021.04.12.21255308v1
8. Palacios R, Patino EG, de Oliveira Piorelli R, Conde MTRP, Batista AP, Zeng G, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Br Med J. 2020;21(1 ):21–3.
9. Palacios, R., Batista, A. P., Albuquerque, C. S. N., Patiño, E. G., Santos, J. D. P., Tilli Reis Pessoa Conde, M.,... & Kallas EG. Efficacy and safety of a COVID-19 inactivated vaccine in healthcare professionals in Brazil: The PROFISCOV study. Prepint [Internet], 2021; Available from: https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3822780
10. World Health Organization (WHO). Interim recommendations for use of the AZD1222 ( ChAdOx1-S [ recombinant ]) vaccine against COVID- 19 developed by Oxford University and AstraZeneca. 2021; 1222(February): 1-7.
11. Wu Z, Hu Y, Xu M, Chen Z, Yang W, Jiang Z, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine (CoronaVac) in healthy adults aged 60 years and older: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infecí Dis [Internet], 2021;0(0):1–9. Available from: www.thelancet.com/infectionPublishedonline
12. Instituto de Salud Púbica-Ministerio de Salud-Chile. Ficha de información general sobre la vacuna CoronaVac suspensión inyectable (vacuna SARS-Cov-2 adsorbida, virión inactivado). 2021;1-2.
13.Instituto Nacional de Salud-Grupo de enfermedades transmisibles. Farmacovigilancia de vacunas. (Evento adverso posterior a la vacunación). Código: 298 Equipo de Inmunoprevenibles. [Internet], 2021. Available from: https://www.ins.gov.co/buscador- eventos/Lineamientos/fa rmacovigilancia-vacunas-05-03-2021.pdf
ANEXO TÉCNICO PARA LA APLICACIÓN DE LA VACUNA DEL GRUPO CHADOX1-S/NCOV-19 (ASTRAZENECA) CONTRA LA COVID-19 (1).
Composición
--Vacuna monovalente compuesta por un vector de adenovirus de chimpancé no replicativo (ChAdOxl) producido mediante técnicas de recombinación de ADN, que expresa la proteína S (espícula) del SARS-CoV-2.
--Cada dosis de 0,5 ml contiene al menos de 5x1010 de unidades infectivas de adenovirus de chimpancé que codifica la proteína S (espícula) del virus SARS-CoV-2.
--La vacuna contiene los siguientes excipientes: L-Histidina, Hidrocloruro de L-histidina monohidrato, Cloruro de magnesio hexahidratado, Polisorbato 80 (E 433), Etanol, Sacarosa, Cloruro de sodio, Edetato disódico (dihidrato), Agua para preparaciones inyectables.
Mecanismo de acción
Las vacunas contra la COVID-19 del grupo ChAdOx1-S son vacunas de vector viral. Los vectores virales se han utilizado para el desarrollo de vacunas durante varias décadas y se caracterizan por una fuerte respuesta de linfocitos CD4 + y CD8 +, incluso en ausencia de un adyuvante, lo que los convierte en un vector de vacuna adecuado para virus patógenos que provocan una fuerte respuesta inmune celular (2,3), utilizando adenovirus humanos (por ejemplo: Ad5, Ad26), adenovirus de origen animal u otros virus para producir vacunas (4).
Las vacunas fueron elaboradas a partir de la modificación genética de un adenovirus recombinante ChAd, que no posee envoltura, es no replicativo y se cultiva en la línea celular humana (HEK293). ChAd, causa resfriado común en los chimpancés, pero no causa enfermedades en humanos y es capaz de expresar la proteína S (espícula) del SARS-CoV-2, coronavirus que causa la COVID-19 (5).
Cuando se inyecta la vacuna, el adenovirus modificado se une a la superficie de las células humanas y entrega el código genético de la proteína S. Las células procesan y fabrican la proteína S que estimula el sistema inmunológico para producir anticuerpos y células de memoria contra el virus SARS-CoV-2 sin causar enfermedad (5). Los anticuerpos frente al vector generados tras la primera dosis no parecen influir en la respuesta humoral a la segunda dosis de la misma vacuna, pero sí en la respuesta celular. Los anticuerpos IgG producidos frente a S, anticuerpos neutralizantes y respuesta de células T con IFNy en todos los participantes tras la segunda dosis, no mostraron interferencia entre la inmunidad previa anti-vector y la respuesta inmune a la primera y a la segunda dosis (6,7).
Presentación, forma farmacéutica e indicación terapéutica
Presentación:
--Caja que contiene 10 viales multidosis.
--El vial es de vidrio transparente con tapón elastomérico y sello de aluminio que contiene 5 ml de suspensión para 10 dosis de 0.5 mi (8).
--Una dosis (0,5 mi) contiene adenovirus que codifica la proteína S del SARS-CoV-2 (ChAdOxI- S/nCoV-19), no menos de 5 * 1010 partículas virales (dosis estándar) (8,9).
--Se incluye un sobrellenado adicional en cada vial para asegurar que se puedan administrar las 10 dosis (vial de 5 ml) de 0,5 ml. Es normal que permanezca líquido en el vial después de retirar la dosis final. No acumule el exceso de vacuna de varios viales y deseche el sobrante según el protocolo respectivo.
Forma farmacéutica: Suspensión inyectable vial de 10 dosis, 0.5 ml por dosis. La suspensión es incolora a ligeramente opalescente.
Indicaciones terapéuticas: Inmunización activa para prevenir la COVID-19 causado por el virus del SARS-CoV-2, en personas de 18 años o más. El uso de esta vacuna debe estar de acuerdo con las recomendaciones del fabricante.
Conservación
--Vial sin abrir: 6 meses cuando se conserva en nevera (+2°C a +8°C) en su envase y empaque original.
--Vial abierto: 6 Horas almacenado a temperatura no mayor a 30°C ó hasta 48 horas después de la apertura (10,11) siempre y cuando está almacenado en refrigeración (+2°C a +8°C)
--Después del período de tiempo descrito anteriormente, el producto debe desecharse. No lo devuelva al refrigerador.
--Desde un punto de vista microbiológico, después de la primera apertura, la vacuna debe usarse inmediatamente.
--Si la vacuna no se usa inmediatamente, en los tiempos y las condiciones de conservación descritas anteriormente, el uso es responsabilidad del prestador.
Nota: Conservar los viales en el embalaje exterior para protegerlos de la luz.
Manejo
--Esta vacuna debe ser manipulada por un profesional sanitario utilizando una técnica aséptica para garantizar la esterilidad de cada dosis.
--No utilice esta vacuna después de la fecha de caducidad que aparece en la etiqueta. La fecha de vencimiento se refiere al último día de ese mes.
--El vial multidosis sin abrir debe conservarse en nevera (entre 2 °C y 8 °C). No congelar.
--La vacuna debe inspeccionarse visualmente para detectar partículas y decoloración antes de su administración.
--Deseche el vial si la suspensión se decolora o se observan partículas visibles.
--No sacuda ni diluya la suspensión.
Eficacia
--Las vacunas del grupo ChAdOx1-S tienen una eficacia del 70,4% (15,16) contra la infección sintomática por SARS-CoV-2, como lo muestra el análisis primario en participantes del ensayo en el Reino Unido, Brasil y Sudáfrica que recibieron 2 dosis estándar.
--Datos de análisis intermedios del ensayo de fase 3 realizado en los Estados Unidos donde se reclutó a 32.449 participantes, de los cuales el 22% de la población del ensayo era de 65 años o más. El análisis primario incluyó eventos a partir de los 15 días posteriores a la segunda dosis, aplicada con un intervalo entre dosis de 28 días. La eficacia de la vacuna contra la infección sintomática por SARS-CoV-2 fue del 76% (IC del 95%: 68-82%). No se produjeron casos graves o críticamente enfermos en el grupo vacunado y se reportaron 8 casos en el grupo de placebo. La eficacia de la vacuna en los participantes del ensayo de 65 años o más fue del 85% (IC del 95%: 58-94%) (17).
--En los participantes entre 18 y 55 años que recibieron dos dosis estándar, después de la segunda dosis, la eficacia fue mayor en aquellos con un intervalo de refuerzo más prolongado >12 semanas (eficacia de la vacuna 81,3% [IC 95% 60,3-91,2]) que en aquellos con un intervalo corto <6 semanas (eficacia de la vacuna 55,1% [33,0-69,9], Estas observaciones están respaldadas por datos de inmunogenicidad que mostraron respuestas de anticuerpos de más del doble después de una intervalo de 12 semanas o más en comparación con un intervalo de menos de 6 semanas (10, 18, 19).
--Los resultados presentados en participantes a partir de 18 años señalan que se encontraron 64 casos confirmados de COVID-19 en el grupo vacunado y 154 casos en el grupo control, 15 días después de la 2a dosis. La eficacia en participantes sin evidencia de infección previa por SARS- CoV-2, en los que se administró con un intervalo entre dosis de 4 a 12 semanas, fue del 59,5% (IC95%: 45,8%-69,7%).
--El 9,8% de los participantes tenían 65 años o más, entre los cuales hubo 12 casos de COVID- 19; 4 en los grupos de vacuna y 8 en el grupo de control (VE = 51,91%; IC del 95%: -59,98% a 85,54 %), 15 días después de la segunda dosis de vacuna (16).
--La eficacia en participantes con una o más comorbilidades fue del 58,3% (IC95%: 33,6%-73,9%), detectándose 25 y 60 casos de COVID-19 en los grupos vacunados (N=2.068) y control, (N=2.040) respectivamente (19).
Dosis, vía, y sitio de administración
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1a dosis(Considérese día 0) | 0,5 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos que por |
| 2a dosis12 semanas (84 días) después de aplicada la primera dosis). | alguna situación particular se requiera aplicar en el brazo derecho. | ||
Nota: No inyectar la vacuna por vía intravascular, subcutánea o intradérmica
Administración
--La serie de vacunas del grupoChAdOx1-S consta de dos dosis de 0,5ml cada una, administradas por vía intramuscular preferiblemente en el músculo deltoides de la parte superior del brazo con un intervalo de 12 semanas (84 días) después de la primera dosis.
--Las personas que hayan recibido la primera dosis de las vacunas del grupo ChAdOx1-S deben recibir la segunda dosis de una de las vacunas del grupo ChAdOx1-S de la presentación: AstraZeneca AZD1222, Sil Covishield y SK Bioscience, considerados equivalentes e intercambiables en ambas dosis para completar el esquema (12,13).
--Si la segunda dosis se administra inadvertidamente antes de las 4 semanas posteriores a la primera, no es necesario repetir la dosis. Si la segunda dosis se retrasa inadvertidamente, debe administrarse lo antes posible.
--Los errores de administración de vacunas deben informarse al sistema de notificación.
--La segunda dosis puede aplicarse con intervalo de cuatro (4) a doce (12) semanas, de manera que pueda coordinarse con la administración del tratamiento de inmunosupresión ya programado.
Nota: Verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante si es así siga el siguiente flujo de información:
--Reporte al coordinador del punto de vacunación su hallazgo.
--No utilice el vial, sepárelo y márquelo como cuarentena.
--Realice un video del vial, evidenciando su hallazgo.
--Realice el reporte al coordinador municipal, por correo electrónico indicando lote y el fabricante para cada uno de los biológicos del grupo ChAdOx1-S, envíe la evidencia.
--Reporte al nivel municipal y/o departamental/distrital.
--El nivel departamental/distrital reportará a este Ministerio vía telefónica a través de los teléfonos del CNE para PAI y enviará el reporte a través del correo electrónico establecido para tal fin.
--Este Ministerio informará al Invima, así como al fabricante el reporte de los hallazgos.
--Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial.
Al finalizar la jornada diaria se debe verificar el número de dosis sobrantes por vial multidosis abierto, éstas deben ser las primeras dosis del vial usadas al día siguiente. Para este caso el vial multidosis abierto ha demostrado estabilidad química y física en uso desde el momento de la perforación del vial hasta la administración por un tiempo no mayor de 6 horas almacenado a temperatura no mayor a 30°C o 48 horas almacenado en un refrigerador (2 a 8°C).
Es importante mencionar que todas las personas a vacunar estén agendadas o no, deben seguir todo el proceso de vacunación, que incluye entre otros, diligenciar y firmar del consentimiento informado, recibir la información relacionada con la vacuna, permanecer el tiempo asignado en las instalaciones posterior a la vacunación según su condición, registrar la información en el PAIWEB y recibir el carné de vacunas.
Técnica para aplicar la vacuna
--Antes, durante y después de la vacunación, todas las personas deben seguir las pautas actuales para la protección contra COVID-19 en su área (por ejemplo, usar tapabocas, mantener la distancia física, higiene de manos) (20).
--Una persona que presente síntomas de COVÍD-19 no debe vacunarse. Se puede ofrecer la vacuna a las personas que se hayan recuperado de la COVID-19 sintomático o asintomático (20).
--Realice higiene de manos
--Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho.
--Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
--Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
--Con una mano estire la piel con los dedos pulgar e índice.
--Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90° sobre el plano de la piel.
--Introduzca la aguja por vía intramuscular.
--Presione el émbolo para que penetre la vacuna.
--Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
--Estire la piel para perder la luz del orificio que dejó la aguja.
--Presione por 30 a 60 segundos con la torunda, sin dar masaje. Al concluir el procedimiento, realice la higiene de manos.
--Al concluir el procedimiento realice la higiene de manos.
Coadministración con otras vacunas
--Debe haber un intervalo mínimo de 14 días entre la administración de esta vacuna y cualquier otra vacuna contra otras enfermedades hasta que se disponga de datos sobre coadministración con otras vacunas (10,20).
--Se debe priorizar la vacunación contra la COVID-19.
--En jornada de vacunación contra la influenza se puede vacunar 14 días antes o después de haber recibido cualquiera de las vacunas del grupo ChAdOx1-S.
Contraindicaciones
--Hipersensibilidad al principio activo o a alguno de los excipientes.
--No debe administrarse una segunda dosis de la vacuna a personas que hayan presentado una reacción de hipersensibilidad grave (de tipo anafiláctico) a una dosis previa de la vacuna.
La vacunación debe posponerse temporalmente en personas con enfermedad aguda grave, pero una enfermedad leve sin fiebre o sin afectación sistémica no es una razón válida para posponer la vacunación.
Advertencias y precauciones especiales (21)
Antes de vacunar lea cuidadosamente el inserto o indicación para prescribir que trae adjunto cada una de las vacunas.
En el trámite para la obtención de la Autorización de Uso de Emergencia (ASUE) la compañía farmacéutica AstraZeneca presentó al Invima documentos relacionados con la seguridad del medicamento biológico en donde se establece dentro de las advertencias y precauciones lo siguiente se debe administrar con precaución en personas con trombocitopenia, cualquier trastorno de coagulación, o a personas que están recibiendo tratamiento de anticoagulación, debido a que puede ocurrir sangrado o formación de hematomas después de una administración intramuscular” (22).
El Invima como autoridad sanitaria acoge las recomendaciones de la OMS y la Agencia Europea de Medicamentos, razón por la cual se solicitó a la farmacéutica que incluya dentro de la información aportada para la Autorización de Uso de Emergencia, la posible presentación de este tipo de eventos adversos. Todo lo anterior dado que se mantiene el balance riesgo - beneficio favorable a la aplicación de la vacuna. De igual forma, el Ministerio de Salud y Protección Social, el Invima y el Instituto Nacional de Salud, trabajan de manera articulada en la vigilancia y seguimiento de cualquier evento adverso presentado posterior a la vacunación, por medio de los reportes a través de los sistemas de notificación: Sivigila (para eventos graves) y VigiFlow (para eventos leves) (22).
Trazabilidad
Para mejorar la trazabilidad de los medicamentos biológicos, se debe registrar claramente el nombre, número de lote y el fabricante de cada uno de los biológicos del grupo ChAdOx1-S administrado.
Hipersensibilidad y anafilaxia
--No se registraron reacciones alérgicas o anafilaxia por la vacuna en el contexto de los ensayos clínicos. En caso de que se produzca un episodio anafiláctico después de la administración de la vacuna, siempre debe estar disponible el tratamiento y la supervisión médica adecuada. Se recomienda una estrecha observación durante al menos 15 minutos después de la vacunación.
--No se debe administrar una segunda dosis de la vacuna a quienes hayan experimentado anafilaxia a la primera dosis con las vacunas del grupo ChAdOx1-S.
Reacciones relacionadas con la ansiedad
Las reacciones relacionadas con la ansiedad, incluidas las reacciones vasovagales (síncope), la hiperventilación o las reacciones relacionadas con el estrés pueden ocurrir en asociación con la vacunación como una respuesta psicógena a la inyección con aguja. Es importante que se tomen precauciones para evitar lesiones por desmayos.
Enfermedad concurrente
La vacunación debe posponerse en personas que padecen una enfermedad febril aguda grave o una infección aguda. Sin embargo, la presencia de una infección leve y/o febrícula no debe retrasar la vacunación.
Trombocitopenia y trastornos de la coagulación
Al igual que con otras inyecciones intramusculares, la vacuna debe administrarse con precaución en personas que reciben terapia anticoagulante o aquellas con trombocitopenia o cualquier trastorno de la coagulación (como hemofilia) porque pueden producirse hemorragias o hematomas después de una administración intramuscular en estas personas. Ver numeral 11.2. "Consideraciones respecto a la vacunación de pacientes con antecedente de desórdenes de la coagulación o anticoagulados" del Anexo 1 de esta resolución.
Se ha observado muy raramente una combinación de trombosis y trombocitopenia, en algunos casos acompañada de hemorragia, tras la vacunación con las vacunas del grupo ChAdOx1-S. Esto incluye casos graves que se presentan como trombosis venosa, incluyendo localizaciones inusuales como la trombosis de senos venosos cerebrales, trombosis de la vena mesentérica, así como trombosis arterial, concomitantes con trombocitopenia. La mayoría de estos casos ocurrieron dentro de los primeros siete a catorce días después de la vacunación y se produjeron en mayor número en mujeres menores de 55 años; sin embargo, esto puede reflejar el mayor uso de la vacuna en esta población. Algunos casos tuvieron un desenlace fatal (19).
El 21 de abril de 2021, Brighton Collaboration publicó una definición de caso provisional para estas enfermedades tromboembólicas eventos asociados con trombocitopenia como "Trombosis con síndrome de trombocitopenia" (TTS). El propósito de la definición de caso provisional es estandarizar la identificación de los casos que deben ser investigados utilizando un protocolo armonizado (23,24).
Los factores de riesgo y el mecanismo biológico del TTS aún se están investigando; Hasta la fecha, no se ha encontrado evidencia de un mayor riesgo o de cualquier otro factor de riesgo para las personas con trastornos de la coagulación o plaquetas. Un estudio publicado recientemente resume las características clínicas y de laboratorio de 11 pacientes en Alemania y Austria que desarrollaron TTS después de la vacunación. Los autores concluyeron que la vacunación con ChAdOx1-S puede resultar en el raro desarrollo de trombocitopenia trombótica inmune, mediada por anticuerpos activadores de plaquetas contra PF4, que simula clínicamente la trombocitopenia autoinmune inducida por heparina. Los hallazgos pueden tener implicaciones clínicas, en términos de conocimiento de los efectos adversos, ensayos para la investigación de casos potenciales y para el tratamiento (25). Estudios adicionales de Noruega y el Reino Unido también han encontrado anticuerpos contra PF4 en la mayoría de los pacientes que desarrollaron TTS después de la vacunación (26,27).
El personal de salud debe estar alerta a los signos y síntomas de tromboembolismo y/o trombocitopenia. Los vacunados deben ser informados para que busquen atención médica inmediata si desarrollan síntomas como dificultad para respirar, dolor en el pecho, inflamación de fas piernas, dolor abdominal persistente después de la vacunación. Además, cualquier persona que después de la vacunación, presente síntomas neurológicos, como dolores de cabeza intensos o persistentes o visión borrosa o que experimente múltiples pequeños hematomas en la piel (petequias) en un lugar diferente al de la vacunación después de unos días, debe buscar atención médica inmediata (19,28).
La OMS emitió unas consideraciones sobre los eventos trombóticos posteriores a la administración de la vacuna de AstraZeneca contra COVID-19 en Europa, en su trabajo coordinado con la Agencia Europea de Medicamentos (EMA). Tomando en cuenta que los beneficios de la vacuna superan los riesgos, la OPS/OMS recomienda a todos los países que continúen utilizando la vacuna de AstraZeneca para enfrentar la COVID-19 mientras se investigan los eventos mencionados; además de continuar el seguimiento de la seguridad de todas las vacunas contra la COVID-19 fomentando la notificación e investigación de presuntos eventos adversos (28,29).
Individuos inmunodeprimidos
--No se ha evaluado la eficacia, seguridad e inmunogenicidad de la vacuna en personas inmunodeprimidas, incluidas las que reciben terapia inmunosupresora. La eficacia de la vacuna Oxford-AstraZeneca AZD1222 (GhAdOx1-S/nCoV-19) puede ser menor en individuos inmunosuprimidos.
--Sin embargo, si forman parte de un grupo recomendado para la vacunación, pueden vacunarse, dado que la vacuna no es de virus replicativo. Se debe proporcionar información y, cuando sea posible, asesoramiento sobre la seguridad y los perfiles de eficacia de las vacunas en personas inmunodeprimidas para fundamentar la evaluación individual de los riesgos y los beneficios.
--Las personas con enfermedades autoinmunes que no tienen contraindicaciones para la vacunación pueden vacunarse.
--Las personas VIH positivas que estén bien controladas con terapia antirretroviraI de gran actividad y que formen parte de un grupo recomendado para la vacunación pueden vacunarse, dado que la vacuna no se replica. No es necesario realizar pruebas de infección por VIH antes de la administración de la vacuna (20).
Anticuerpos monoclonales o plasma (20)
Las personas que han recibido anticuerpos monoclonales o plasma de convalecencia como parte del tratamiento con COVID-19, la vacunación debe posponerse durante al menos 90 días para evitar la interferencia del tratamiento con la respuesta inmune inducida por la vacuna.
Duración de la protección
Se desconoce la duración de la protección que brinda la vacuna, ya que aún está siendo determinada por ensayos clínicos en curso.
Limitaciones de la efectividad de la vacuna
--La protección comienza aproximadamente 3 semanas después de la primera dosis de la vacuna Oxford-AstraZeneca AZD1222 (ChAdOx1-S/nCoV-19). Es posible que las personas no estén completamente protegidas hasta 15 días después de la administración de la segunda dosis.
--Como ocurre con todas las vacunas, la inmunización con el biológico de Oxford-AstraZeneca AZD1222 (ChAdOx1-S/nCoV-19) puede no proteger a todos los receptores de la vacuna.
--Para personas mayores de 65 años, teniendo en cuenta la totalidad de la evidencia, la vacunación se recomienda ya que la respuesta inmune en las personas mayores está bien documentada y es similar a las de otros grupos de edad (20).
Interacción con otros medicamentos, otras formas de interacción e incompabilidades
--No se han realizado estudios de interacción. No se ha estudiado la administración concomitante de la vacuna del grupoChAdOx1-S con otras vacunas.
--No mezclar las vacunas ChAdOx1-S con otras vacunas / productos en la misma jeringa.
--Este medicamento no debe mezclarse con otros medicamentos ni diluirse.
Fertilidad, embarazo y lactancia (1,10)
Fertilidad
--Los estudios en animales no indican efectos nocivos directos o indirectos con respecto a la toxicidad reproductiva.
--Los estudios en animales de toxicidad potencial para la reproducción y el desarrollo aún no se han completado (15).
Embarazo
--Los datos disponibles sobre la administración de las vacunas del grupo ChAdOx1-S en mujeres embarazadas son insuficientes para evaluar la eficacia de la vacuna y / o informar los riesgos asociados con la vacuna durante el embarazo.
--Según los resultados del estudio preliminar, no se esperan efectos sobre el desarrollo del feto.
--Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según un estudio convencional de toxicidad por dosis repetidas. Sin embargo, no se han concluido estudios de toxicidad en animales.
--No se realizaron estudios de genotoxicidad ni carcinogenicidad. No se espera que los componentes de la vacuna tengan potencial genotóxico.
--Un estudio preliminar de toxicidad reproductiva en ratones no muestra toxicidad en madres o fetos.
--Las gestantes deben recibir vacunas del grupo ChAdOx1-S solo si el beneficio de la vacunación para la mujer embarazada supera los riesgos potenciales de la vacuna, como si son trabajadores de la salud con alto riesgo de exposición o si tienen comorbilidades que las colocan en un grupo de alto riesgo para COVID-19 severo.
--Las vacunas del grupo ChAdOx1 -S es una vacuna que no se replica (20).
--La OMS no recomienda las pruebas de embarazo antes de la vacunación o retrasar el embarazo debido a la vacunación (20).
Lactancia
--No existen datos o son limitados sobre el uso de las vacunas del grupo ChAdOx1-S en mujeres lactando o sobre los efectos en los niños amamantados (20).
--No se puede excluir el riesgo para los recién nacidos/lactantes alimentados al seno. Se desconoce si las vacunas del grupo ChAdOx1-S se excreta en la leche materna.
--La lactancia materna ofrece importantes beneficios para la salud de las mujeres lactantes y de sus hijos amamantados. Se espera que la eficacia de la vacuna sea similar en mujeres lactantes que en otros adultos.
--Como las vacunas del grupo ChAdOx1-S no se replican (es decir, que no produce nuevas partículas de virus), es poco probable que represente un riesgo para el niño que recibe seno materno (20). Sobre la base de estas consideraciones, a una mujer lactante que forme parte de un grupo recomendado para la vacunación, por ejemplo, los trabajadores de la salud, se le debe ofrecer la vacuna. La OMS recomienda continuar la lactancia materna después de la vacunación (10).
Consideraciones para la vacunación de adultos mayores (edad > 65 años)
Hubo pocas personas mayores de 65 años reclutadas para los ensayos clínicos. Sin embargo, la respuesta inmunitaria inducida por la vacuna está bien documentada y es similar a las de otros grupos de edad. Teniendo en cuenta la totalidad de la evidencia disponible, la OMS recomienda la vacuna para su uso en personas de 65 años o más (10).
Efectos sobre la capacidad para conducir y utilizar máquinas
Las vacunas del grupo ChAdOx1-S tiene una influencia nula o insignificante sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunas de las reacciones adversas pueden afectar temporalmente la capacidad para conducir o utilizar máquinas.
Reacciones adversas esperadas
--Según el resumen de perfil de seguridad de las vacunas del grupo ChAdOx1-S, se basa en un análisis intermedio de datos combinados de los ensayos clínicos realizados en el Reino Unido, Brasil y Sudáfrica (15).
--Las reacciones adversas notificadas con más frecuencia fueron sensibilidad en el lugar de la inyección (63,7%), dolor en el lugar de la inyección (54,2%), dolor de cabeza (52,6%), fatiga (53,1%), mialgia (44,0%), malestar (44,2%), pirexia (incluye fiebre (33,6%) y fiebre > 38 °C (7,9%)), escalofríos (31,9%), artralgias (26,4%) y náuseas (21,9%) (8).
--La mayoría de las reacciones adversas fueron de gravedad leve a moderada y, por lo general, se resolvieron a los pocos días de la vacunación. En comparación con la primera dosis, las reacciones adversas notificadas después de la segunda dosis fueron más leves y menos frecuentes.
--Se presentaron 175 eventos adversos graves (84 en el grupo que recibió la vacuna y 91 en el grupo control). Tres eventos posiblemente estuvieron relacionados con la intervención: el primero corresponde a una mielitis transversa que se produjo 14 días después de una vacuna de refuerzo que se consideró de etiología idiopática; el segundo: una anemia hemolítica en un receptor del grupo control, y el tercero presentó fiebre superior a 40 °C dos días después de la primera dosis, se recuperó y recibió la segunda dosis sin reacción. Dos casos adicionales de mielitis transversa se consideraron poco probables relacionados con la intervención: uno 10 días después de la primera dosis de la vacuna que se atribuyó a esclerosis múltiple preexistente no diagnosticada y otro se presentó en el grupo de control que ocurrió 68 días después de la vacunación. Los casos de mielitis transversa dieron como resultado una pausa temporal del ensayo que continuó después de que el comité independiente de neurólogos expertos y todos los participantes se han recuperado o se están recuperando (15,30).
--La reactogenicidad fue generalmente más leve y se informó con menos frecuencia en adultos mayores (>65 años).
--El perfil de seguridad fue consistente entre los participantes con o sin evidencia previa de infección por SARS-CoV-2 al inicio del estudio; el número de participantes seropositivos al inicio del estudio fue de 718 (3,0%) (1).
--Al tratarse de un medicamento nuevo es importante notificar cualquier acontecimiento adverso que ocurra tras la vacunación al sistema de notificación.
--Esta vacunación no interfiere con las pruebas de PCR o de detección de antígeno. Una prueba positiva IgM/lgG a la proteína S puede indicar vacunación o infección previa. Si fuera necesario valorar en una persona vacunada la evidencia de una infección previa mediante serología se deberá usar una prueba específica IgG frente a nucleocápside (19).
Sobredosis (1)
No existe un tratamiento específico para una sobredosis con las vacunas del grupo ChAdOx1-S. En caso de sobredosis, se debe controlar al individuo y proporcionarle el tratamiento sintomático según corresponda.
Vacunación segura
Antes de recibir las vacunas grupo ChAdOx1-S debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo si:
--Tiene alguna alergia. Es importante indagar si ha presentado reacción alérgica grave después de cualquier otra inyección de vacuna o después de que le han administrado alguna de las vacunas del grupo ChAdOx1-S en el pasado.
--Si alguna vez se ha desmayado después de una inyección con aguja.
--Tiene fiebre
--Tiene problemas de hemorragia o hematomas, o si está tomando un medicamento anticoagulante (para prevenir la formación de coágulos de sangre).
--Si su sistema inmunológico no funciona correctamente (inmunodeficiencia) o si está tomando medicamentos que debilitan el sistema inmunológico (como corticosteroides en dosis altas, inmunosupresores o medicamentos contra el cáncer).
--Ha recibido otra vacuna contra la COVID-19
--En caso de ser mujer en edad reproductiva preguntar:
-Está embarazada o planea quedar embarazada
-Está amamantando
Se debe recomendar a las personas que hayan recibido las vacunas del grupo ChAdOx1-S que busquen atención médica inmediata si experimentan alguno de los siguientes síntomas (31):
--Dificultad para respirar
--Dolor en el pecho
--Inflamación de las piernas
--Dolor abdominal que persiste después de la vacunación
--Cualquier persona con síntomas neurológicos
--Dolores de cabeza intensos o persistentes que empeoran
--Visión borrosa que se produce varios días después de la vacunación.
--Hematomas (en cualquier lugar que no sea el lugar de la inyección)
--Petequias que aparecen unos días o más después de la vacunación.
Busque atención médica urgente si presenta síntomas de una reacción alérgica grave. Estas reacciones pueden incluir una combinación de cualquiera de los siguientes síntomas: sensación de desmayo o mareo, cambios en los latidos del corazón, dificultad para respirar, sibilancias, inflamación de labios, cara o garganta, ronchas o sarpullido, náuseas o vómitos, dolor de estómago.
Verifique si el usuario solicita su segunda dosis: evaluar el carné de vacunación y si no lo trae, proceda a verificar en el PAIWEB el tipo de vacuna que se aplicó en su primera dosis, antes de pasarlo al paso de ruta de la aplicación de la vacuna.
Nota: Ver ítem contraindicaciones y las advertencias y precauciones especiales del empleo de esta vacuna
Fuentes de información
1. European Medicines Agency (EMA). Vaxzevria (COVID-19 Vaccine AstraZeneca). Guía Técnica. 2021;(January 29):1-34.
2. Prüâ BM. Current State of the first covid-19 vaccines. Vaccines. 2021;9(1): 1-12.
3. Ura T, Okuda K, Shimada M. Developments in viral vector-based vaccines. Vaccines. 2014;2(3):624-41.
4. Tan WG, Jin H-T, West EE, Penaloza-MacMaster P, Wieland A, Zilliox MJ, et al. Comparative Analysis of Simian Immunodeficiency Virus Gag-Specific Effector and Memory CD8 + T Cells Induced by Different Adenovirus Vectors. J Viral. 2013;87(3): 1359–72.
5, COVID-19: the green book chapter 14a Coronavirus (COVID-19) vaccination Information for public health professionals. Public Health England.
6. Krammer F. SARS-CoV-2 vaccines in development. Nature [Internet]. 2020;586(7830):516-27. Available from: http://dx.doi.org/10.1038/s41586-020-2798-3
7. Poland GA, Ovsyannikova IG, Kennedy RB. SARS-CoV-2 immunity: review and applications to phase 3 vaccine candidates. Lancet [Internet], 2020:396(10262): 1595-606. Available from: http://dx.doi.Org/10.1016/S0140-6736(20)32137-1
8. Invima. Resolución 2021005436 del 23 de febrero de2021. Por la cual se otroga <sic> la ASUE para la vacuna AZD1222 del Laboratorio AstraZeneca.pdf.
9. Voysey M, Ann S, Clemens C, Madhi SA, Weckx LY, Folegatti PM, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. N Engl J Med. 2020;1–13.
10. World Health Organization (WHO). Interim recommendations for use of the AZD1222 (ChAdOx1-S [ recombinant ]) vaccine against COVID- 19 developed by Oxford University and AstraZeneca. 2021; 1222(February): 1-7.
11. Serum Institute of India. ChAdOx1 nCoV-19 Corona Virus Vaccine (Recombinant). 2021; 3:18– 9.
12. World Health Organization. Considerations for optimizing deployment of ChAdOx1-S [recombinant] vaccines in a timelimited constrained supply situation (AstraZeneca/AZD1222- Vaxzevria, AstraZeneca/SK Bioscience and Sll/Covishield vaccines). 2021; Available from: https://www.who.int/publications/m/item/considerations-for-optimizing-deployment-of-astrazeneca-azd1222-and-sii-covishield-vaccines-in-a-time-limited-constrained-supply- situation
13. World Health Organization. Interim recommendations for use of the ChAdOx1-S [recombinant] vaccine against COVID-19 (AstraZeneca COVID-19 vaccine AZD1222, Sil Covishield, SK Bioscience) Update21 April 2021. 2021; 19 (lnterim guidance):1-8.
14. ECDC Technical Report. OverView of EU/EEA country recommendations on COVID-19 vaccination with Vaxzevria, and a scoping review of evidence to guide decision-making Key messages Background Vaccine roll-out in the EU/EEA. (May). Available from: https://www.ecdc.europa.eu/en/publications-data/overview-eueea-country-recommendations- covid-19-vaccination-vaxzevria-and-scoping
15. Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, etal. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled triáis in Brazil, South Africa, and the UK. Lancet. 2021 1397(10269):99- 111.
16. World Health Organization. Interim recommendations for use of the AZD1222 (ChAdOx1-S [recombinant]) vaccine against COVID- 19 developed by Oxford University and AstraZeneca. 2021;1222(February):1-7.
17. World Health Organization (WHO). Interim recommendations for use of the ChAdOx1-S [recombinant] vaccine against COVID-19 (AstraZeneca COVID-19 vaccine AZD1222, SIl Covishield, SK Bioscience). 2021;2(Abril 23 2021):1-23.
18. Voysey M, Costa Clemens SA, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised triáis. Lancet. 2021;397(10277):881-91.
19. Consejo Inter-territorial. Sistema Nacional de Salud. Vaxzevria. COVID-19 Vaccine AstraZeneca [Internet]. España; 2021. 1-10 p. Available from:
https://www.mscbs.gob.eS/profesionales/saludPublica/prevPromocion/vacunaciones/covid19/docs/Guia_Tecnica_AstraZeneca.pdf
20. World Health Organization. COVID-19 Vaccine Explainer COVID-19 Vaccine ChAdOx1-S [recombinant], Developed by Oxford University and AstraZeneca. 2021;(26 February):1-6.
21. Gov.UK. Summary of the Public Assessment Report for AstraZeneca COVID-19 vaccine - GOV.UK. 2021;1-22. Available from: WHO/2019-nCoV/vaccines/SAGE_recommendation/AZD1222/2021.2
22. Invima. Estado sobre el reporte de eventos adversos presuntamente asociados al uso de la vacuna contra covid-19 desarrollada por AstraZeneca [Internet], 7 de abril. 2021 [cited 2021 Apr 30]. Available from: https://www.invima.gov.co/web/guest/estado-sobre-el-reporte-de-eventos- adversos-presuntamente-asociados-al-uso-de-la-vacuna-contra-covid-19-desarrollada-por- astrazeneca?redirect=%2Fweb%2Fguest%2Fnoticias-2021
23. Wise RP, Bonhoeffer J, Beeler J, Donato H, Downie P, Matthews D et al. Thrombocytopenia: case definition and guidelines for collection, analysis, and presentation of immunization safety data. Vaccine [Internet], 2007, 1 (25)131. Available from: www.ncbi.nlm.nih.gov/pubmed/17493712
24. Group. BCTW. Draft Case Definition of Thrombosis and Thromboembolism. Available from: brightoncollaboration.us/draft-case-definition-ofthrombosis-and-thromboembolism/
25. Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA ES. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med [internet], Available from: www.ncbi.nlm.nih.gov/pubmed/33835769
26. Scully M, Singh D, Lown R, Poles A, Solomon T, Levi M et al Pathologic Antibodies to Platelet Factor 4 after ChAdOx1 nCoV-19 Vaccination. N Engl J Med. 16 April 2021. N Engl J Med [Internet]. Available from: https://www.ncbi.nlm.nih.gov/pubmed/33861525
27. Schultz NH, Sorvoll IH, Michelsen AE, Munthe LA, Lund-Johansen F, Ahlen MT et al. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. 2021; Available from: www.ncbi.nlm.nih.gov/pubmed/33835768
28. World Health Organizaron. Consideraciones sobre los eventos trombóticos posteriores a la administración de la vacuna de AstraZeneca contra COVID-19 en Europa, 7 de abril. 2021; Available from: https://www.paho.org/es/documentos/consideraciones-sobre-eventos- tromboticos-supuestamente-atribuibles-administracion
29. World Health Organizaron. Statement of the WHO Global Advisory Committee on Vaccine Safety (GACVS) subcommittee on safety signals related to the AstraZeneca COVID-19 vaccine. 2021;(March):19-21.
30. Knoll MD, Wonodi C. Oxford-AstraZeneca COVID-19 vaccine efficacy. Lancet. 2021;397(10269):72-4.
31. Canadá SCG de. Vacuna AstraZeneca contra COVID-19 y COVISHIELD: Riesgo de trombosis con trombocitopenia. Available from: https://canadiensensante.gc.ca/recall-alert-rappel-avis/hc-sc/2021/75211a-fra.php
32. Instituto Nacional de Salud-Grupo de enfermedades transmisibles. Farmacovigilancia de vacunas. (Evento adverso posterior a la vacunación). Código: 298 Equipo de Inmunoprevenibles. [Internet], 2021. Available from: https://www.ins.gov.co/buscador-eventos/Lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf
ANEXO TÉCNICO PARA LA APLICACIÓN DE LA VACUNA AD26.COV2.S JANSSEN CONTRA LA COVID-19.
Generalidades
La vacuna Ad26.COV2.S de Janssen filial Johnson and Johnson se basa en un vector de adenovirus humano Ad26 (1), que por sus características genéticas es incapaz de replicarse en las personas (2), actuando como vehículo para el material genético que codifica la proteína S del SARS-CoV-2.
El adenovirus transporta el gen que codifica el antígeno S a una célula humana; una vez dentro de la célula, utiliza este gen para producir la proteína S y lo presenta en su superficie. El antígeno S presentado desencadena una respuesta inmune que ayudará a preparar al cuerpo para responder a la exposición futura al SARS-CoV-2.
Cuando una persona recibe la vacuna, sus células leerán las instrucciones genéticas y producirán la proteína S, su sistema inmunológico tratará a esta proteína como extraña y producirá defensas naturales (anticuerpos y células T) contra ella. Si más adelante, la persona vacunada entra en contacto con el SARS-CoV-2, el sistema inmunológico reconocerá el virus y estará preparado para atacarlo. Los anticuerpos y las células inmunes pueden trabajar juntos para neutralizar el virus, prevenir su entrada en las células del cuerpo y destruir las células infectadas, ayudando así a protegerse contra SARS-CoV-2/COVID-19 (3).
Presentación, forma farmacéutica e indicación terapéutica (2,4)
Presentación:
Caja por 10 viales multidosis de vidrio con tapón de goma sin látex, sello de aluminio y tapa de plástico azul.
--Un vial multidosis de 2,5 mi contiene 5 dosis (0,5 mi cada una).
--Cada dosis contiene 5 x 1010 partículas virales.
Forma farmacéutica:
Suspensión estéril para inyección intramuscular de incolora a ligeramente amarilla, transparente a muy opalescente (2).
Componentes:
La vacuna contiene los siguientes ingredientes inactivos: ácido cítrico monohidrato, citrato trisódico dihidrato, etanol, 2-hidroxipropil-â-ciclodextrina (HBCD), polisorbato 80, cloruro de sodio, hidróxido de sodio, ácido clorhídrico y Agua para preparaciones inyectables.
Indicaciones terapéuticas: Inmunización activa para prevenir la COVID-19 causado por el virus del SARS-CoV-2, en personas de 18 años o más.
Conservación (2,5,6)
--La vacuna Ad26.COV2.S fabricada por Janssen inicialmente se almacena congelada por el fabricante a una temperatura entre -20°C a ±5°C con una vida útil de 24 meses.
--Almacenada de 2 °C a 8 °C durante 6 meses.
--Si la vacuna aún está congelada al recibirla, descongélela entre 2 °C y 8 °C.
--Una caja de 10 viales tardará aproximadamente 2 horas en descongelarse y un vial individual tardará aproximadamente 1 hora en descongelarse
--No vuelva a congelar una vez descongelado.
--Una vez extraída la primera dosis, el vial debe mantenerse entre 2 °C y 8 °C durante un máximo de 6 horas.
--El vial debe desecharse si la vacuna no se usa dentro de estos tiempos.
Eficacia y seguridad (2,5,7,8)
--Los análisis de los criterios de valoración secundarios demostraron que una sola dosis de Ad26.COV2.S tiene una eficacia del 66,9% (IC del 95%: 59,0 - 73,4) contra la infección sintomática del SARS-CoV-2.
--De las 21.895 personas que recibieron una dosis única de la vacuna Ad26.COV2.S en los estudios clínicos, el 80.5% tenía entre 18 y 64 años, 19.5% tenía 65 años o más y 3.7% tenía 75 años o más.
--La eficacia contra la COVID-19 grave después de 14 días fue del 76,7% (IC del 95%: 54,6 - 89,1) y después del día 28 de 85,4% (IC del 95%: 54,2 - 96,9).
--La eficacia de la vacuna contra las hospitalizaciones fue del 93,1% (IC del 95%: 72,7 - 99,2).
--Se observó una estimación de eficacia de la vacuna más baja para el subgrupo de participantes de 60 años o más con comorbilidades en comparación con la población general.
--No hubo muertes relacionadas con COVID-19 ni casos de COVID-19 que requirieran intervención médica después de la vacunación a los participantes de 60 años o más con comorbilidades médicas en el grupo vacuna.
--Los resultados de la eficacia para otros subgrupos con un pequeño número de participantes (£75 años, ciertos subgrupos raciales) tienen una interpretación limitada.
--Los datos fueron insuficientes para evaluar la eficacia en participantes con evidencia de infección previa por SARS-CoV-2.
--No se observaron diferencias globales de seguridad o eficacia en los participantes de los ensayos clínicos.
--Se informó que los datos de seguridad con una mediana de seguimiento de 58 días después de la vacunación demostraron un perfil de tolerabilidad aceptable sin preocupaciones de seguridad significativas.
Preparación y administración de la vacuna
--Inspeccione visualmente los viales de la vacuna Ad26.COV2.S de Janssen, la solución debe ser incolora a ligeramente amarilla, transparente a muy opalescente. Sin presencia de partículas ni decoloración antes de la administración. Si existe alguna de estas condiciones, no administre la vacuna (5).
--Antes de retirar cada dosis de la vacuna, mezcle cuidadosamente el contenido del vial multidosis girando suavemente en posición vertical durante 10 segundos.
No sacudir, ni agitar.
--La vacuna está lista para usarse después de abierta.
--Cada vial de 2,5 mi contiene 5 dosis de 0,5 mi cada dosis.
--Es posible que quede un remanente al extraer las 5 dosis, No acumule el exceso de vacuna de múltiples viales.
--Registre la fecha y la hora del primer uso en la etiqueta del vial de la vacuna AÓ26.COV2.S de Janssen.
--Después de que se haya administrado la primera dosis, mantenga el vial entre 20 y 8 °C durante un máximo de 6 horas.
--Los errores de administración de vacunas deben informarse al sistema de notificación (ver vigilancia de ESAVI).
Nota: Verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante si es así siga el siguiente flujo de información:
1. Reporte al coordinador del punto de vacunación su hallazgo.
2. No utilice el vial, sepárelo y márquelo como cuarentena.
3. Realice un video del vial, evidenciando su hallazgo.
4. Realice el reporte al coordinador municipal, por correo electrónico indicando lote y fabricante y envíe la evidencia.
5. Reporte al nivel municipal y/o departamental/distrital.
6. El nivel departamental/distrital reportará a este Ministerio vía telefónica a través de los teléfonos del CNE para PAI y enviará el reporte a través del correo electrónico establecido para tal fin.
7. El MSPS informará al Invima, así como al fabricante el reporte de los hallazgos.
8. Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial.
Dosis, vía, y sitio de administración
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| DOSIS ÚNICA | 0.5 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho. |
Nota: No inyectar la vacuna por vía intravascular, subcutánea o intradérmica
Técnica para aplicar la vacuna
--Realice la higiene de las manos antes de manipular el vial del biológico, entre la atención de pacientes y siempre que se ensucien las manos.
--Antes, durante y después de la vacunación, todas las personas deben seguir las pautas actuales para la protección contra la COVID-19 en su área (por ejemplo, usar tapabocas, mantener la distancia física e higiene de manos).
--Lea cuidadosamente el inserto o indicación para prescribir que trae adjunto cada una de las vacunas.
--Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho.
--Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
--Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
--Antes de inyectar, compruebe que la jeringa con la dosis de vacuna no está fría al tacto, que contiene el volumen adecuado de 0,5 ml y que el producto no presenta partículas ni anormalidades de color.
--Con una mano estire la piel con los dedos pulgar e índice.
--Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90° sobre el plano de la piel.
--Introduzca la aguja por vía intramuscular.
--Presione el émbolo para que penetre la vacuna.
--Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
--Estire la piel para perder la luz del orificio que dejó la aguja.
--Presione por 30 a 60 segundos con la torunda, sin dar masaje. Al concluir el procedimiento, realice lavado o higiene de manos.
Coadministración con otras vacunas
--No hay datos que permitan evaluar la administración concomitante de la vacuna Ad26.COV2.S de Janssen con otras vacunas.
--Se desconoce si la reactogenicidad de la vacuna la COVID-19 aumenta con la coadministración, incluso con otras vacunas que se sabe que son más reactogénicas.
--Si bien los estudios de coadministración están en curso, según el CDC, las vacunas contra la COVID-19 y otras vacunas ahora se pueden administrar al mismo tiempo. Esto incluye la administración simultánea de vacunas COVID-19 y otras vacunas el mismo día, así como dentro de los 14 días.
--Si la vacuna Ad26.COV2.S de Janssen se administra simultáneamente con otras vacunas inyectables, estas deben administrarse en diferentes sitios de inyección.
--No mezcle la vacuna Ad26.COV2.S de Janssen con ninguna otra vacuna en la misma jeringa.
Observación post-vacunación
Durante el estudio clínico no se presentaron reacciones alérgicas graves; sin embargo, debido a algunas reacciones alérgicas presentadas posterior al inicio de la vacunación, el fabricante recomienda que las personas vacunadas permanezcan en observación. Se debe informar al usuario de las posibles reacciones adversas y cuales deben ser las conductas en caso de presentarse.
Contraindicaciones (2)
--No administre la vacuna Ad26.COV2.S de Janssen a personas con antecedentes conocidos de una reacción alérgica grave (por ejemplo, anafilaxia) a cualquier componente de la vacuna Ad26.COV2.S de Janssen (Ver componentes de la vacuna)
Advertencias y Precauciones (5,9)
--El tratamiento médico apropiado para manejar las reacciones alérgicas inmediatas debe estar disponible en caso de que ocurra una reacción anafiláctica aguda después de la administración de la vacuna Ad26.COV2.S de Janssen (7) por ello debe garantizarse el periodo de observación (7).
--Inmunocompetencia alterada: las personas inmunodeprimidas, incluidas las personas que reciben terapia inmunosupresora, pueden tener una respuesta inmunitaria disminuida a la vacuna Ad26.COV2.S de Janssen.
--Limitaciones de la eficacia de la vacuna: Es posible que la vacuna Ad26.COV2.S de Janssen no proteja a todas las personas vacunadas.
--Cualquier persona con una enfermedad febril aguda (temperatura corporal superior a 38,5 °C) debe posponer la vacunación hasta que esté afebril.
Reacciones adversas esperadas (2)
--En los estudios clínicos se notificaron reacciones alérgicas graves, incluida anafilaxia, tras la administración de la vacuna Ad26.COV2.S de Janssen. Las reacciones adversas pueden ser graves, y hacerse evidentes con el uso más generalizado de la vacuna Ad26.COV2.S de Janssen (9).
--Los estudios de seguridad de la vacuna mostraron que las reacciones adversas más comunes asociadas con Ad26.COV2.S fueron: locales como dolor en el lugar de la inyección (48,6%) y sistémicas como dolor de cabeza (38,9%), fatiga (38,2%), mialgia (33,2%), nauseas (14,2%) y fiebre (0,2%), estos fueron predominantemente leves y moderados, con 0,7% y 1,8% de reacciones adversas locales y sistémicas, respectivamente.
--Se demostró que la reactogenicidad a Ad26.COV2.S en adultos >18 años de edad es transitoria, y la mayoría de los eventos adversos (EA) se resolvieron entre 1 y 2 días después de la vacunación.
--Los informes de reacciones adversas fueron menos comunes entre los participantes de 60 años o más.
--Se notificó urticaria en cinco personas vacunadas y en una persona que recibió placebo.
--Dentro de los 21.895 del grupo vacunado hubo 77 casos de hipersensibilidad (0.4%) vs. 65 casos (0.3%) en el grupo placebo (n= 21.888). Rash cutáneo 35 casos en el grupo vacunado y 23 en el placebo. Urticaria 8 casos en el grupo vacunado y 5 en el grupo placebo (todas no graves) en los 7 días posteriores a la vacunación. En el grupo vacunado se presentaron 10 casos de dermatitis y eczemas frente a 16 en el placebo. Edema e inflamación se presentó en 7 casos (grupo vacunado) y 3 en el placebo. Manifestaciones en ojos, nariz y garganta en 10 de los vacunados con Ad26.COV2.S y 16 en el grupo placebo.
--Además, se notificó un ESAVI grave de hipersensibilidad, en un individuo vacunado que inició con urticaria dos días después de la vacunación y angioedema de los labios sin dificultad respiratoria cuatro días después de la vacunación. El evento probablemente estuvo relacionado con la vacuna.
--Un ESAVI de dolor severo en el brazo inyectado, que no responde a los analgésicos, con inicio inmediato en el momento de la vacunación, y que continuaba 74 días después de la vacunación, se informó en una persona que recibió la vacuna.
--Una persona notificó un ESAVI de debilidad generalizada severa, fiebre y dolor de cabeza, que comenzó ai día siguiente a la vacunación y se resolvió tres días después de la vacunación, probablemente relacionado con la vacuna.
Se observaron otros eventos en los receptores de la vacuna vs. los receptores de placebo:
| Evento | Grupo vacunado | Grupo control (placebo) |
| Eventos tromboembólicos: Trombosis venosa profunda | 6 eventos (2 graves: 5 en los 28 días posteriores a la vacunación) | 2 eventos (1 grave; 2 en los 28 días posteriores a la vacunación) |
| Embolia pulmonar | 4 eventos (3 graves; 2 en los 28 días posteriores a la vacunación) | 1 evento (grave y en los 28 días posteriores a la vacunación) |
| Trombosis del seno transverso | 1 evento (grave y dentro de los 28 días de la vacunación) | 0 |
| Convulsiones | 4 eventos (1 grave; 4 dentro de los 28 días posteriores a la vacunación). 3 participantes con historia de epilepsia y 1 posterior a la trombosis del seno transverso | 1 evento (0 grave y 0 dentro de los 28 días posteriores a la vacunación) |
| Tinnitus | 6 eventos (0 graves; 6 en los 28 días posteriores a la vacunación, incluidos 3 en los 2 días posteriores a la vacunación) | 0 |
| Guillan Barré | 1 evento | 1 evento |
| Neuropatía periférica | 2 eventos | 2 eventos |
| Parálisis de Bell | 3 eventos | 2 eventos |
Fuente: Elaboración propia a partir de (2,5)
--Para estos eventos, no se puede determinar una relación causal con la vacuna Ad26.COV2.S de Janssen. La evaluación de la causalidad se vio confundida por la presencia de afecciones médicas subyacentes que pueden haber predispuesto a las personas a estos eventos. Se informaron 3 muertes en el grupo vacunado y 16 en el grupo placebo, todos los cuales fueron considerados por los investigadores como no relacionados a la vacunación.
--No hubo patrones adicionales notables o desequilibrios numéricos entre los grupos de tratamiento para categorías específicas para eventos adversos graves (incluidos eventos neurológicos, neuroinflamatorios y cardiovasculares) que sugieran una relación causal con la vacuna Ad26.COV2.S de Janssen.
Sobredosis (4)
No se ha reportado ningún caso de sobredosis con la vacuna Ad26.COV2.S de Janssen, que fue bien tolerada en los estudios Fase 1/2, en los que se administraron dosis mayores (hasta el doble); no obstante, los que recibieron la vacuna reportaron un incremento de la reactogenicidad.
No existe un tratamiento específico para una sobredosis con la vacuna Ad26.COV2.S de Janssen. En caso de sobredosis, se recomienda el monitoreo de las funciones vitales y eventualmente un tratamiento sintomático según corresponda.
Interacción con otros medicamentos y otras formas de interacción (4)
--No se han realizado estudios de interacción. No se ha estudiado la administración concomitante de la vacuna de Ad26.COV2.S de Janssen con otras vacunas.
--No mezclar la vacuna Ad26.COV2.S de Janssen con otras vacunas / productos en la misma jeringa.
Vacunación de poblaciones especificas (7)
Personas mayores. Los estudios clínicos de la vacuna Ad26.COV2.S de Janssen incluyeron a personas de 65 años o más y sus datos contribuyen a la evaluación general de la seguridad y eficacia. De las 21.895 personas que recibieron una dosis única de la vacuna Ad26.COV2.S de Janssen en COV3001, el 19,5% (n = 4.259) tenían 65 años o más y el 3,7% (n = 809) tenían 75 años o más.
El riesgo de COVID-19 severo y muerte aumenta abruptamente con la edad. Los datos del ensayo de fase 3 indican que la eficacia y la seguridad de la vacuna son comparables en todos los grupos de edad (mayores de 18 años). Se recomienda la vacunación para personas mayores.
--Personas con comorbilidades. Se han identificado ciertas comorbilidades que aumentan el riesgo de enfermedad grave por COVID-19 y muerte. El ensayo clínico de fase 3 demostró que la vacuna tiene perfiles de seguridad y eficacia similares en personas con diversas afecciones médicas subyacentes, incluidas aquellas que las ponen en mayor riesgo de COVID-19 grave. Las comorbilidades estudiadas en el ensayo clínico de fase 3 incluyeron hipertensión, enfermedad pulmonar crónica, enfermedad cardíaca significativa, obesidad, diabetes e infección por el virus de la inmunodeficiencia humana (VIH). Se recomienda la vacunación para personas con tales comorbilidades que se han identificado que aumentan el riesgo de COVID-19 grave.
--Embarazo (4). La experiencia con el uso de la vacuna Ad26.COV2.S de Janssen en mujeres embarazadas es muy limitada (5,9). Los estudios con la vacuna Ad26.COV2.S de Janssen en animales, no revelaron efectos nocivos en lo que concierne a la toxicidad reproductiva.
--Los datos de seguridad con otras vacunas de Janssen basadas en Ad26 administradas durante los 3 meses previos del embarazo, así como durante el embarazo, no han mostrado evidencia de un mayor riesgo de resultados adversos para la madre o el niño, en más de 1600 embarazos reportados con más de 900 embarazos concluidos.
--Es posible considerar la administración de la vacuna Ad26.COV2.S de Janssen durante el embarazo cuando los beneficios potenciales superen cualquier riesgo para la madre y el feto, como si son trabajadores de la salud con alto riesgo de exposición o si tienen comorbilidades que las colocan en un grupo de alto riesgo para COVID-19 severo.
--Las mujeres embarazadas tienen un mayor riesgo de sufrir COVID-19 grave en comparación con las mujeres en edad fértil que no están embarazadas, y la COVID-19 se ha asociado con un mayor riesgo de parto prematuro (5,9).
--Lactancia (4). En los estudios clínicos fase 3 de la vacuna Ad26.COV2.S de Janssen se incluyeron mujeres en periodo de lactancia. Se desconoce si los componentes de la vacuna Ad26.COV2.S o los anticuerpos inducidos por la vacuna se excretan en la leche materna.
--No se dispone de datos para evaluar los efectos de la vacuna Ad26.COV2.S de Janssen en el lactante o en la producción/excreción de leche (5,9). No se anticipan efectos en el niño amamantado considerando los resultados de estudios en animales y humanos con vacunas basadas en Ad26 que muestran una diseminación limitada de este vector, incapaz de replicarse, luego de la inyección intramuscular.
--Se debe considerar la administración de la vacuna Ad26.COV2.S durante la lactancia cuando los beneficios potenciales superen cualquier riesgo potencial para la madre y el niño.
--La vacuna Ad26.COV2.S de Janssen es de vector no replicativo, biológica y por lo tanto, clínicamente poco probable que represente un riesgo para el niño que amamanta. Sobre la base de estas consideraciones, una mujer lactante que forma parte de un grupo recomendado para la vacunación, por ejemplo, a los trabajadores de la salud, se les debe ofrecer la vacunación sopesando riesgo beneficio. La OMS recomendó continuar la lactancia materna después de la vacunación para la Ad26.COV2.S de Janssen (7).
--Fertilidad (4). En un estudio de toxicidad para el desarrollo reproductivo, se administró a conejos hembras 1 ml de la vacuna Ad26.COV2.S de Janssen (una dosis única humana es de 0,5 ml) mediante inyección intramuscular 7 días antes del apareamiento y en los días 6 y 20 de gestación. No se observaron efectos adversos relacionados con la vacuna sobre la fertilidad femenina, el desarrollo embriofetal o posnatal hasta el día 28 posnatal (5).
--Un estudio de toxicidad convencional (dosis repetidas) no reveló ningún efecto sobre los órganos sexuales masculinos, que pudiera afectar la fertilidad masculina.
--Personas que viven con el VIH (4). En los estudios clínicos fase 3 de la vacuna Ad26.COV2.S de Janssen se incluyeron adultos con infección por VIH estable (bien controlada), no se observó ningún problema de seguridad.
--Las personas que viven con el virus de la inmunodeficiencia humana (VIH) pueden tener un mayor riesgo de contraer COVID-19 grave.
--Es posible que la respuesta inmunitaria a la vacuna se reduzca, lo que puede reducir su eficacia clínica.
--Las personas que viven con el VIH que forman parte de un grupo recomendado para la vacunación pueden vacunarse.
--No es necesario realizar una prueba de infección por VIH antes de la administración de la vacuna.
--Personas inmunodeprimidas (4). En los estudios clínicos fase 3 de la vacuna Ad26.COV2.S de Janssen se incluyeron adultos bajo terapia inmunosupresora crónica a dosis bajas (menos de 20 mg de prednisona o equivalente).
Los sujetos inmunodeprimidos, incluidos los que reciben terapia inmunosupresora, pueden desarrollar una respuesta inmunitaria disminuida a la vacuna Ad26.COV2.S de Janssen.
Las personas inmunodeprimidas tienen un mayor riesgo de contraer COVID-19 grave. Actualmente, los datos disponibles son insuficientes para evaluar la eficacia de la vacuna o los riesgos asociados a la vacuna en personas gravemente inmunodeprimidas, incluidas las que reciben terapia inmunosupresora. Es posible que la respuesta inmunitaria a la vacuna se reduzca, lo que puede reducir su eficacia clínica. Mientras tanto, dado que la vacuna es de vector no replicativo, las personas inmunodeprimidas que forman parte de un grupo recomendado para la vacunación pueden vacunarse.
--Personas que han tenido previamente una infección por SARS-CoV-2, La vacuna debe ofrecerse independientemente del historial de una persona de infección por SARS-CoV-2 sintomática o asintomática. No se recomiendan las pruebas virales o serológicas para detectar una infección previa con el fin de tomar decisiones sobre la vacunación. Los datos de los análisis combinados indican que Ad26.COV2.S es seguro en personas con evidencia de infección previa por SARS-CoV-2.
--Los datos disponibles muestran que la reinfección sintomática es poco común dentro de los 6 meses posteriores a una infección natural.
--Dado el suministro limitado de vacunas, las personas con infección por SARS-CoV-2 confirmada por PCR en los 6 meses anteriores pueden retrasar la vacunación hasta cerca del final de este período.
--Personas con COVID-19 agudo actual. Las personas con COVID-19 agudo confirmado por PCR no deben vacunarse hasta que se hayan recuperado de la enfermedad aguda y se hayan cumplido los criterios para la interrupción del aislamiento. Aún no se conoce el intervalo óptimo entre una infección natural y la vacunación.
--Personas que previamente recibieron terapia con anticuerpos pasivos para COVID-19. Actualmente no hay datos sobre la seguridad o eficacia de la vacunación en personas que recibieron anticuerpos monoclonales o plasma de convalecencia como parte del tratamiento con COVID-19.
La vacunación debe posponerse durante al menos 90 días para evitar la interferencia del tratamiento con anticuerpos con las respuestas inmunitarias inducidas por la vacuna.
--Trombosis con Trombocitopenia (4)
--Se ha observado muy raramente una combinación de trombosis y trombocitopenia, en algunos casos acompañada de sangrado, después de la vacunación con la vacuna Ad26.COV2.S de Janssen. Estos casos ocurrieron aproximadamente una a dos semanas después de la vacunación.
--Esto incluye trombosis del seno venoso cerebral (TSVC) y puede conllevar a un desenlace fatal. Estudios de serie de casos se han realizado con el fin de informar la orientación clínica a medida que se vacuna con Ad26.COV2.S (10).
--La posibilidad de tener un TSVC con trombocitopenia es remota.
--Los profesionales de la salud deben estar atentos a los signos y síntomas de tromboembolismo y/o trombocitopenia.
--Se debe indicar a las personas vacunadas que busquen atención médica inmediata si desarrollan síntomas como dificultad para respirar, dolor en el pecho, dolor o hinchazón en las piernas o dolor abdominal progresivo después de la vacunación.
--Cualquier persona con síntomas neurológicos que incluyan dolores de cabeza intensos o persistentes o visión borrosa después de la vacunación, o que experimente moretones en la piel (petequias) más allá del sitio de vacunación después de unos días, debe buscar atención médica inmediata.
--Dado que el tratamiento puede ser diferente a la práctica médica habitual para los episodios tromboembólicos sí los pacientes presentan trombocitopenia concomitante, los profesionales de la salud deben consultar la guía correspondiente (por ejemplo, de las autoridades sanitarias locales o grupos de expertos) y/o consultar a especialistas (por ejemplo, hematólogos) para diagnosticar y tratar esta condición.
El Síndrome de trombosis con trombocitopenia TTS (por sus siglas en inglés) (11,12) es un síndrome poco común que implica trombosis arterial o venosa aguda y trombocitopenia de nueva aparición en pacientes sin exposición reciente conocida a la heparina, que inicia después de la vacunación y se caracteriza por presentar:
1. Trombosis, particularmente en sitios inusuales que incluyen: Trombosis del seno venoso cerebral (CVST), Trombosis esplácnica, portal, mesentérica
2. Trombocitopenia leve a grave (recuento de plaquetas <150.000 X pL)
3. Ensayos positivos de ELISA de IgG anti-factor 4 (PF4) y activación plaquetaria.
El TTS parece ser similar a la trombocitopenia con trombosis inducida por heparina (HITT), una reacción rara al tratamiento con heparina similar, que se caracteriza por la inducción de anticuerpos anti-PF4. Fisiológicamente, la heparina es una sustancia producida por varias células de nuestro cuerpo, especialmente el sistema inmunitario, por ejemplo, mastocitos o macrófagos. Funciona activando la antitrombina e inhibiendo la coagulación sanguínea. A concentraciones más altas, también afecta la función de las plaquetas (trombocitos) y el colesterol. Por supuesto, las cantidades producidas por nuestro cuerpo son mínimas.
En las personas que presenten TTS, se debe evitar el uso de heparina, inicie la terapia con Ig IV y anticoagulación sin heparina en espera de los resultados del ELISA de PF4 si:
--- Signos / síntomas de trombosis grave Y al menos uno de los siguientes:
-Imágenes positivas O
-Plaquetas bajas * O
- Ambas cosas
Si PF4 ELISA es negativo y no hay trombocitopenia, se descarta TTS. Tratar como tromboembolismo venoso estándar.
Efectos sobre la capacidad para conducir y utilizar máquinas
No se ha estudiado el efecto de la vacuna Ad26.COV2.S de Janssen sobre la capacidad de conducir y utilizar máquinas. Algunos de los efectos mencionados en la sección Reacciones Adversas pueden afectar temporalmente la capacidad para conducir o utilizar máquinas.
Vacunación segura
Antes de recibir las vacunas Ad26.COV2.S de Janssen debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo:
--Tiene alguna alergia. Es importante indagar al usuario si ha presentado reacción alérgica grave.
--Si alguna vez se ha desmayado después de una inyección con aguja.
--Tiene fiebre
--Tiene problemas de hemorragia o hematomas, o si está tomando un medicamento anticoagulante (para prevenir la formación de coágulos de sangre).
--Si su sistema inmunológico no funciona correctamente (inmunodeficiencia) o si está tomando medicamentos que debilitan el sistema inmunológico (como corticosteroides en dosis altas, inmunosupresores o medicamentos contra el cáncer).
--Ha recibido otra vacuna contra la COVID-19
--En caso de ser mujer en edad reproductiva preguntar:
-Está embarazada o planea quedar embarazada
-Está amamantando
Se debe recomendar a las personas que hayan recibido la vacuna Ad26.COV2.S de Janssen que busquen atención médica inmediata si experimentan alguno de los siguientes síntomas (13):
--Dificultad para respirar
--Dolor en el pecho
--Inflamación de las piernas
--Dolor abdominal que persiste después de la vacunación
--neurológicos
--Dolores de cabeza intensos o persistentes que empeoran
--Visión borrosa que se produce varios días después de la vacunación.
--Hematomas (en cualquier lugar que no sea el lugar de la inyección)
--Petequias que aparecen unos días o más después de la vacunación.
Busque atención médica urgente si presenta síntomas de una reacción alérgica grave. Estas reacciones pueden incluir una combinación de cualquiera de los siguientes síntomas: sensación de desmayo o mareo, cambios en los latidos del corazón, dificultad para respirar, sibilancias, inflamación de labios, cara o garganta, ronchas o sarpullido, náuseas o vómitos, dolor de estómago.
Verifique, si el usuario solicita su segunda dosis: evaluar el carné de vacunación y si no lo trae, proceda a verificar en el PAI WEB el tipo de vacuna que se aplicó en su primera dosis, antes de pasarlo a la ruta de la aplicación de la vacuna
Nota: Ver ítem contraindicaciones y las advertencias y precauciones especiales del empleo de esta vacuna
Fuentes de información
1. Winslow RL, Milligan ID, Voysey M, Luhn K, Shukarev G, Douoguih M, et al. Immune responses to novel adenovirus type 26 and modified vaccinia virus Ankara-vectored ebola vaccines at 1 year [Internet], Vol. 317, JAMA - Journal of the American Medical Association. American Medical Association; 2017 [cited 2021 Mar 2]. p. 1075-7. Available from: https://jamanetwork.com/
2. Food and Drug Administration. Vaccines and Related Biological Products Advisory Committee Meeting February 26, 2021 FDA Briefing Document Janssen Ad26.COV2.S Vaccine for the Prevention of COVID-19. FDA. 2021; 1-53.
3. EMA. EMA starts rolling review of Janssen's COVID-19 vaccine Ad26.COV2.S. 2021;31(December):2-4. Available from: https://www.ema.europa.eu/en/news/ema-starts-rolling-review-curevacs-covid-19-vaccine-cvncov
4. Janssen Therapeutics D of JP. Alcance Vacuna Covid IPP CCDS abril 2021. 2021;1-114.
5. Food and Drug Administration. Fact sheet for healthcare providers administering vaccine (vaccination providers) Emergency Use Authorization (EUA) of the Janssen COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19). 2021;
6. Invima - Instituto Nacional de Vigilancia de Medicamentos y Alimentos. Resolución No. 2021020677 del 27 de Mayo de 2021 [Internet], 2021. Available from: https://www.invima.gov.co/documents/20143/3933320/16084381_2021020677_temp.pdf
7.World Health Organizaron. Interim recommendations for the use of the Janssen Ad26.COV2.S (COVID-19) vaccine: interim guidance, 17 March 2021. World Health Organization. 2021. p. 1- 7.
8. Sadoff J, Gray G, Vandebosch A, Cárdenas V, Shukarev G, Grinsztejn B, et al. Safety and Efficacy of Single-Dose Ad26.COV2.S Vaccine against Covid-19. N Engl J Med. 2021; 1-15.
9. Janssen Therapeutics D of JP. The Janssen COVID-19 Vaccine: Important safety Information. 2021.
10. See I, Su JR, Lale A, Woo EJ, Guh AY, Shimabukuro TT, et al. US Case Reports of Cerebral Venous Sinus Thrombosis with Thrombocytopenia after Ad26.COV2.S Vaccination, March 2 to April 21, 2021. JAMA - J Am Med Assoc. 2021,30329:1-9.
11. American Society of Hematology. Thrombosis with Thrombocytopenia Syndrome (also termed Vaccine-induced Thrombotic Thrombocytopenia) [Internet], Versión 1.4. 2021. Available from: https://www.hematology.org/covid-19/vaccine-incluced-immune-thrombotic-thrombocytopenia %0A
12. British Haematology Society. Guidance produced by the Expert Haematology Panel (EHP) focussed on Vaccine induced Thrombosis and Thrombocytopenia (VITT) [Internet], 28 de mayo. 2021. Available from: https://b-s-h.org.uk/about-us/news/guidance-produced-by-the-expert- haematoíogy-panel-ehp-focussed-on-vaccine-induced-thrombosis-and-thrombocytopenia-vitt/ %0A
13. Canadá SCG de. Vacuna AstraZeneca contra COVID-19 y COVISHIELD: Riesgo de trombosis con trombocitopenia. Available from: https://canadiensensante.gc.ca/recall-alert-rappel-avis/hc- sc/2021/75211a-fra.php
14. Instituto Nacional de Salud-Grupo de enfermedades transmisibles. Farmacovigilancia de vacunas. (Evento adverso posterior a la vacunación). Código: 298 Equipo de Inmunoprevenibles. [Internet]. 2021. Available from: https://www.ins.gov.co/buscador-eventos/Lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf
ANEXO TÉCNICO PARA LA APLICACIÓN DE LA VACUNA MODERNA RNAM-1273 CONTRA LA COVID-19.
<Anexo sustituido por el anexo 7, según artículo 6, de la Resolución 1703 de 2022. El TEXTO ORIGINAL es el siguiente:>
Generalidades de la vacuna
La vacuna elaborada por Switzerland GMBH contra la COVID-19 denominada Moderna ARNm-1273 es ARN mensajero monocatenario producido mediante transcripción in vitro acelular, que codifica la proteína de la espícula (S) viral del SARS-CoV-2.
La vacuna estimula las defensas naturales (sistema inmunitario) y funciona haciendo que el organismo genere protección (anticuerpos) contra el virus que causa la COVID-19. Utiliza el ARNm para transportar las instrucciones con las cuales las células producen la proteína de espículas que se encuentra en el virus. Luego, las células del sistema inmunitario son estimuladas para fabricar anticuerpos contra la proteína de las espículas para luchar contra el virus y proteger a la persona vacunada contra la COVID-19 (1).
La vacuna contiene los siguientes excipientes: lípido SM-102, colesterol, 1,2-diestearoil-sn-glicero-3- fosfocolina (DSPC), 1,2-dimiristoil-rac-glicero-3-metoxipolietilenglicol-2000 (PEG2000 DMG), trometamol, clorhidrato de trometamol, ácido acético, acetato de sodio trihidrato, sacarosa, agua para preparaciones inyectables.
Presentación, forma farmacéutica e indicación terapéutica
Presentación:
--Caja por 10 viales multidosis, las cuales pueden venir con las siguientes dosis:
--Vial multidosis con un contenido de 10 dosis de 0,5 ml.
--Vial multidosis con un contenido máximo de 11 dosis: Rango de 10 a 11 dosis (0,5ml cada una).
--Vial multidosis con un contenido máximo de 15 dosis: Rango de 13 a 15 dosis (0,5ml cada una).
--Una dosis (0,5 mi) contiene 100 microgramos de ARN mensajero (ARNm) (encapsulado en nanopartículas lipídicas SM-102).
Forma farmacéutica:
--Concentrado dispersión inyectable. '
--La vacuna es un líquido de color blanco o blanquecino (pH: 7,0 - 8,0) tanto en el vial como en la jeringa.
Indicaciones terapéuticas:
--Inmunización activa para prevenir la COVID-19.causado por el virus del SARS-CoV-2, en personas de 12 años o más. Esta vacuna debe utilizarse conforme a las recomendaciones del fabricante.
Conservación
Periodo de validez
--Vial sin abrir
| --Conservada congelada entre -25°C y -15°C tiene una duración de 9 meses. --Una vez descongelada, la vacuna no se debe volver a congelar. --Se debe mantener la cadena de frío y evitar la exposición de los viales a la luz solar y ultravioleta. --La vacuna debe descongelarse antes de su administración. --Después de descongelar, se pueden extraer 10 dosis (0,5 mi cada una) de cada vial. |  |
| --Los viales de la vacuna sin abrir pueden almacenarse refrigerados de +2°C a +8 C, protegida de la luz, durante un máximo de 30 días antes de retirar la primera dosis. --La vacuna sin abrir, tras extraerla de las condiciones de refrigeración puede almacenarse entre 8 'C y 25 °C durante 24 horas. |  |
--Vial perforado
| --La estabilidad química y física en uso ha sido demostrada durante 19 horas entre 2'C y 25 °C después de la primera perforación (dentro del periodo de uso permitido de 30 días entre 2°C y 8°C y de 24 horas entre 8°C y 25°C). --Desde un punto de vista microbiológico, el medicamento debe utilizarse de inmediato. Si la vacuna no se utiliza inmediatamente, los tiempos y las condiciones de conservación durante el uso son responsabilidad del usuario. |  |
Eficacia
Se ha demostrado que la vacuna ARNm-1273 contra COVID-19 desarrollada por Moderna tiene una eficacia del 94,1%, según una mediana de seguimiento de dos meses. Se mantuvo una alta eficacia en todos los grupos de edad (mayores de 18 años) y no se vio afectada por el sexo o la etnia. Los datos revisados por la OMS en este momento respaldan la conclusión de que los beneficios conocidos y potenciales del ARNm-1273 superan los riesgos conocidos y potenciales (2-4).
La eficacia frente a la COVID-19 severa fue del 100% (IC=95%).
Dosis, vía, y sitio de administración (4,5)
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1* dosis(Considérese día 0) | 0,5 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos que por alguna |
| 2ª dosis(28 días después de aplicada la primera dosis) | situación particular se requiera aplicar en el brazo derecho. | ||
Nota: No inyectar la vacuna por vía intravascular, subcutánea o intradérmica
Administración (4,6) (Resolución 092 del 26 de enero de 2022)
--La serie de vacunas de Moderna ARNm-1273 consta de dos dosis administradas por vía intramuscular cada una de 0,5 ml.
--La población de 12 y más años se aplicará la segunda dosis con un intervalo de 28 días y no antes; sin embargo, las segundas dosis administradas dentro de un periodo de gracia de 4 días antes de la fecha recomendada para la segunda dosis aún se consideran válidas
--La vacuna no debe mezclarse en la misma jeringa con otras vacunas u otros medicamentos.
--El fabricante no ha evaluado la seguridad o eficacia de la vacuna de Moderna ARNm-1273 fuera de los intervalos evaluados en el estudio de fase III.
--El fabricante no sugiere ni recomienda el uso de la vacuna Moderna RNAm-1273 de cualquier otra manera que no sea la descrita en documento regulatorio aprobado localmente.
Intercambiabilidad (4,6)
--La información de que se dispone sobre la intercambiabilidad de la vacuna Moderna RNAm- 1273.con otras vacunas de ARNm u otras plataformas de vacuna COVID-19 para completar la serie de vacunación es limitada a la fecha. La vacunación con esquemas heterólogos (productos diferentes en cada dosis del esquema) debe limitarse a. personas con inmunosupresión (descritas en el numeral 8.2.).
--Se recomienda que ambas dosis de la serie deben completarse con el mismo producto.
--En situaciones excepcionales en las que el producto de la vacuna de ARNm administrado para la primera dosis no se puede determinar o ya no está disponible, se puede administrar cualquier vacuna de ARNm COVID-19 disponible en un intervalo mínimo de 28 días entre dosis para completar la serie de vacuna de ARNm COVID-19.
--Si se administran dos dosis de diferentes productos de la vacuna de ARNm COVID-19 en estas situaciones (o inadvertidamente), no se recomiendan dosis adicionales de ninguno de los productos en este momento. Estas personas se consideran completamente vacunadas contra COVID-19 a 2 semanas después de recibir la segunda dosis de una vacuna de ARNm.
Coadministración con otras vacunas
--No hay datos que permitan evaluar la administración concomitante de la vacuna de Moderna ARNm-1273 con otras vacunas.
--Se desconoce si la reactogenicidad de la vacuna COVID-19 aumenta con la coadministración, incluso con otras vacunas que se sabe que son más reactogénicas.
--Si bien los estudios de coadministración están en curso, según el CDC, las vacunas COVID-19 y otras vacunas ahora se pueden administrar al mismo tiempo. Esto incluye la administración simultánea de vacunas COVID-19 y otras vacunas el mismo día, así como dentro de los 14 días.
--Si la vacuna de Moderna ARNm-1273 se administra simultáneamente con otras vacunas inyectables, estas deben administrarse en diferentes sitios de inyección.
--No mezcle la vacuna de Moderna ARNm-1273 con ninguna otra vacuna en la misma jeringa.
Preparación de la vacuna
Procedimiento para la descongelación de la vacuna
--El vial multidosis se almacena congelado y debe descongelarse antes de su uso.
--La caja térmica de Moderna ARN-m 1273 contiene 10 viales multidosis de vacuna congelados (10 dosis cada uno).
--Una vez abierta, descongelar los viales introduciéndolos al refrigerador para descongelarlos a una temperatura de +2°C a +8°C, alrededor de 2 horas y 30 minutos o dejar el vial 1 hora a temperatura ambiente (entre 15°C y 25 °C).
--Antes de administrar la vacuna dejar el vial a temperatura ambiente durante 15 minutos y marcar el vial con la fecha y hora de descongelación (Nota: NO descongelar los viales desde el día anterior).
Procedimiento para la administración de la vacuna
--La vacuna debe ser administrada por un profesional sanitario mediante técnicas asépticas para garantizar la esterilidad del procedimiento.
--Inicialmente realice lavado o higiene de manos.
--La vacuna está lista para usarse una vez descongelada.
--Verifique que el líquido tiene un color blanco o blanquecino tanto en el vial como en la jeringa.
--La vacuna puede contener partículas blancas o transparentes relacionadas con el producto.
--Gire el vial suavemente después de la descongelación y antes de cada extracción. No agitar ni sacudir.
--Una vez descongelado el vial de la vacuna se pueden extraer diez (10) dosis (de 0,5 mi cada una).
--Una vez descongelado el vial de la vacuna NO volver a congelar.
--Extraiga la dosis de 0,5 ml de vacuna con una aguja y una jeringa estériles de 1ml (22G o 23G) convencional o auto descartadle según disponibilidad y deseche cualquier vacuna no utilizada dentro de las 19 horas posteriores a la extracción de la primera dosis.
--Si la dosis es incorrecta, o hay un cambio de color y otras partículas presentes, no se debe administrar la vacuna.
--Se incluye un sobrellenado adicional en cada vial para garantizar que puedan administrarse 10 dosis de 0,5 ml. No acumule el exceso de vacuna de múltiples viales.
Nota: Verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante si es así siga el siguiente flujo de información:
1. Reporte al coordinador del punto de vacunación su hallazgo.
2. No utilice el vial, sepárelo y márquelo como cuarentena.
3. Realice un video del vial, evidenciando su hallazgo.
4. Realice el reporte al coordinador municipal, por correo electrónico indicando lote y fabricante y envíe la evidencia.
5. Reporte al nivel municipal y/o departamental/distrital.
6. El nivel departamental/distrital reportará a este Ministerio vía telefónica a través de los teléfonos del CNE para PAI y enviará el reporte a través del correo electrónico establecido para tal fin
7. Este Ministerio informará al Invima, así como al fabricante el reporte de los hallazgos.
8. Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial. '
--Al finalizar la jornada diaria se deben identificar las dosis sobrantes por inasistencia de personas a las citas o disminución del cálculo de la pérdida por frasco abierto.
--Posteriormente, identificar la población que no se encuentre vacunada y aplicar la vacuna priorizando según fase y etapa en la cual se está desarrollando la vacunación. Si es el caso, usar la(s) dosis en personas incluidas en la siguiente etapa.
--Es importante mencionar que todas las personas a vacunar estén agendadas o no, deben seguir todo el proceso de vacunación, que incluye entre otros, diligenciar y firmar del consentimiento informado, recibir la información relacionada con la vacuna, permanecer el tiempo asignado en las instalaciones posterior a la vacunación según su condición, registrar la información en el PAIWEB y recibir el carné de vacunas.
Técnica para aplicar la vacuna
--Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho.
--Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
--Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
--Con una mano estire la piel con los dedos pulgar e índice.
--Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90° sobre el plano de la piel.
--Introduzca la aguja por vía intramuscular.
--Presione el émbolo para que penetre la vacuna.
--Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
--Estire la piel para perder la luz del orificio que dejó la aguja.
--Presione por 30 a 60 segundos con la torunda, sin dar masaje. Al concluir el procedimiento, realice la higiene de manos.
Contraindicaciones
--Un historial de anafilaxia a cualquier componente de la vacuna es una contraindicación para la vacunación.
--La vacuna Moderna RNAm-1273 no debe administrarse a personas con antecedentes de anafilaxia al polietilenglicol (PEG), uno de los componentes de la vacuna.
--Si se produce anafilaxia después de la primera dosis, no se debe administrar una segunda dosis de la vacuna ARNm-1273 o de ARNm-BNT162b2 (Pfizer).
Precauciones
--Un historial de anafilaxia a cualquier otra vacuna o terapia inyectable (es decir, vacunas o terapias intramusculares, intravenosas o subcutáneas) se considera una precaución, pero no una contraindicación para la vacunación. Para estas personas, un profesional de la salud con experiencia especializada en trastornos alérgicos debe realizar una evaluación de riesgos. Estas personas aún pueden recibir la vacuna. Aún es incierto si existe un mayor riesgo de anafilaxia, pero deben ser asesorados sobre el riesgo potencial de anafilaxia y los riesgos deben sopesarse con los beneficios de la vacunación. Estas personas deben ser observadas durante 30 minutos después de la vacunación en entornos de atención médica donde la anafilaxia se puede tratar de inmediato.
--Las personas con una reacción alérgica no anafiláctica inmediata, definida esta como signo o síntoma, como urticaria, angioedema o síntomas respiratorios sin ningún otro síntoma (tos, sibilancias, estridor), que se presente dentro de las 4 horas posteriores a la administración de la primera dosis no deben recibir dosis adicionales, a menos que se recomiende después de una revisión por parte de un profesional de la salud con experiencia especializada. Sin embargo, sujeto a la evaluación individual de riesgo-beneficio, el ARNm-1273 podría proporcionarse bajo una estrecha supervisión médica si es la única opción disponible para personas con alto riesgo de COVID-19 grave.
--Se ha informado de un pequeño número de reacciones anafilácticas en vacunados sin antecedentes de anafilaxia. Por lo anterior, la OMS recomienda que la vacuna ARNm-1273 se administre solo en entornos donde se pueda tratar la anafilaxia. Hasta disponer de más datos y conocimientos con respecto a la anafilaxia después de la vacunación con ARNm-1273, todos los vacunados deben ser observados durante al menos 15 minutos después de la vacunación.
--Los alimentos, el veneno de insectos, las alergias por contacto, la rinitis alérgica, el eccema y el asma no se consideran una precaución. Los tapones de los viales no están hechos con látex de caucho natural y no hay contraindicaciones ni precauciones para la vacunación de personas con alergia al látex. Además, como el ARNm-1273 no contiene huevos ni gelatina, no existe ninguna contraindicación o precaución para la vacunación de personas con alergia a cualquier sustancia alimentaria.
--Cualquier persona con una enfermedad febril aguda (temperatura corporal superior a 38,5'C) debe posponer la vacunación hasta que esté afebril.
--Ver la evaluación según el riesgo en la siguiente tabla.
Evaluación de personas candidatas a la vacunación frente a la COVID-19 de Moderna
| PODRÍAN VACUNARSE | PRECAUCIONES | CONTRAINDICACIONES |
| CONDICIONES | CONDICIONES | CONDICIONES |
| Ante la falta actual de evidencia: -- Personas inmunocomprometidas. La vacuna se considera igual de segura, la respuesta inmune puede ser inferior a lo habitual en población general. -- Embarazadas. Se puede valorar el balance beneficio/riesgo en situaciones con alto riesgo de exposición y/o complicaciones. | En enfermedad aguda moderada o grave y en mastocitosis: Evaluar el riesgo valorar posponer la vacunación - Observar durante un tiempo de 15 minutos si la persona ya ha sido vacunada previamente | Ninguna |
| PUEDEN VACUNARSE | PRECAUCIONES | CONTRAINDICACIONES |
| ALERGIAS | ALERGIAS | ALERGIAS |
| Antecedente de alergias no relacionadas con componentes de la vacuna, otras vacunas o tratamientos inyectables, como: Alergia a medicamentos orales (incluyendo el equivalente oral de un medicamento inyectable) --Alergias alimentarias, a animales, insectos, venenos, alérgenos ambientales, látex etc.--Historia familiar de anafilaxia | - Antecedente de reacción alérgica a otras vacunas o tratamientos inyectables (diferentes a los componentes de la vacuna de Moderna o polisorbato, en estos casos la vacuna está contraindicada). | - Antecedentes de lo siguiente son contraindicaciones de recibir la vacuna de Moderna: --Reacción alérgica grave (por ejemplo, anafilaxia) tras una dosis previa de o cualquiera de sus Componentes. --Reacción alérgica inmediata de cualquier gravedad a una dosis previa de o cualquiera de sus componentes. --Reacción alérgica inmediata de cualquier gravedad a polisorbato. |
| ACTUACION | ACTUACIÓN | ACTUACIÓN |
| --Observar durante un tiempo de 30 minutos a las personas con antecedentes de reacciones alérgicas graves (por ejemplo, anafilaxia) por cualquier causa. --Observar durante un tiempo de 15 minutos a las personas con antecedentes de reacciones alérgicas no anafilácticas. | Evaluar del riesgo --Valorar posponer la vacunación --Observar durante un tiempo de 30 minutos si la persona ya ha sido vacunada | --No vacunar --Derivar para estudio en Servido de Alergia/ Inmunología |
Fuente: Dirección General de Salud Pública (Consejería de Sanidad) (7)
Advertencias y precauciones especiales de empleo (8,9)
Trazabilidad
Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
--Antes de vacunar lea cuidadosamente el inserto o indicación para prescribir que trae adjunto cada una de las vacunas.
--Se pueden producir reacciones relacionadas con ansiedad, incluidas reacciones vasovagales (síncope), hiperventilación o reacciones relacionadas con estrés, asociadas al acto vacunal como respuesta psicógena a la inyección con aguja. Es importante tomar precauciones para evitar lesiones a causa de un desmayo.
--La vacunación se debe posponer en personas que presenten una enfermedad febril aguda grave o una infección aguda. La presencia de una infección leve y/o de fiebre de baja intensidad no debe posponer la vacunación.
--Como sucede con otras inyecciones intramusculares, la vacuna debe administrarse con precaución a las personas que reciban tratamiento anticoagulante o a aquellas que presenten trombocitopenia o padezcan un trastorno de la coagulación (como hemofilia) debido a que en estas personas se puede producir sangrado o formación de hematomas tras una administración intramuscular.
--No se ha evaluado la eficacia, la seguridad ni la inmunogenicidad de la vacuna en personas inmunodeprimidas, incluidas aquellas que estén recibiendo tratamiento inmunosupresor. La eficacia de la vacuna puede ser menor en personas inmunodeprimidas.
--Se desconoce la duración de la protección proporcionada por la vacuna, ya que todavía se está determinando en ensayos clínicos en curso.
--Las personas pueden no estar totalmente protegidas hasta 14 días después de la segunda dosis. Como con cualquier vacuna, la vacunación con Moderna ARNm-1273 puede no proteger a todas las personas que la reciban.
--No se dispone de datos sobre la seguridad y eficacia del ARNm-1273 en personas con afecciones autoinmunes, aunque estas personas fueron elegibles para la inscripción en los ensayos clínicos. Las personas con enfermedades autoinmunes que no tienen contraindicaciones para la vacunación pueden vacunarse.
--Las personas inmunodeprimidas, incluidas las personas que reciben terapia inmunosupresora, pueden tener una respuesta inmunitaria disminuida a la vacuna. No hay datos disponibles sobre el uso concomitante con inmunosupresores.
--Personas con inmunosupresión severa por cualquier causa (incluye personas con VIH no controlado), pueden vacunarse, aunque la respuesta inmunológica por su estado podría no garantizar la eficacia demostrada de la vacuna.
--Debido a que en los ensayos de Fase III, no fueron incluidos, no se tiene información sobre la vacunación personas menores de 18 años, ni de mujeres embarazadas por lo que por ahora esta población no será incluida en la vacunación contra la COVID-19.
Vacunación de poblaciones específicas (4)
Poblaciones para las que se dispone de datos de apoyo de ensayos clínicos de fase 2/3
Personas mayores
--El riesgo de COVID-19 severo y muerte aumenta abruptamente con la edad. Los datos del ensayo de fase 3 indican que la eficacia y la seguridad de la vacuna son comparables en todos los grupos de edad (mayores de 18 años).
--Se recomienda la vacunación para las personas mayores sin un límite de edad. Los estudios de efectividad de la vacuna posteriores a la introducción han demostrado una alta efectividad y buenos perfiles de seguridad en este grupo de edad.
Personas con comorbilidades
--Se han identificado ciertas comorbilidades que aumentan el riesgo de enfermedad grave por COVID-19 y muerte. El ensayo clínico de fase 3 demostró que la vacuna tiene perfiles de seguridad y eficacia similares en personas con diversas afecciones médicas subyacentes, incluidas aquellas que las ponen en mayor riesgo de COVID-19 grave. Las comorbilidades estudiadas en el ensayo clínico de fase 3 incluyeron enfermedad pulmonar crónica, enfermedad cardíaca significativa, obesidad grave, diabetes, enfermedad hepática e infección por el virus de la inmunodeficiencia humana (VIH).
Poblaciones para las que existen datos limitados o nulos del ensayo clínico de fase 3
Niños y adolescentes
Se están realizando estudios para evaluar la inmunogenicidad y seguridad del ARNm-1273 en niños y adolescentes. En la actualidad, las personas menores de 18 años no deben vacunarse con esta vacuna.
Mujeres embarazadas
--La experiencia con el uso de la vacuna COVID-19 Moderna ARNm-1273 en mujeres embarazadas es limitada. Los estudios realizados en animales no sugieren efectos perjudiciales directos ni indirectos con respecto al embarazo, el desarrollo embriofetal, el parto o el desarrollo posnatal.
--Los estudios de toxicología reproductiva y del desarrollo completados en animales no han mostrado efectos nocivos de la vacuna durante el embarazo.
--Actualmente no se dispone de datos de ensayos clínicos sobre seguridad e inmunogenicidad en el embarazo. Hasta el momento, los datos de farmacovigilancia de la vacuna posteriores a la introducción no han identificado ningún problema agudo de seguridad, con un perfil de reactogenicidad y eventos adversos similar al informado en ausencia de embarazo.
Personas que viven con el VIH
--Las personas que viven con el VIH pueden tener un mayor riesgo de contraer COVID-19 grave.
--La vacuna no es un virus vivo, las personas que viven con el VIH que forman parte de un grupo recomendado para la vacunación pueden vacunarse.
--Las personas VIH positivas que están bien controladas con terapia antirretroviral de gran actividad son parte de un grupo recomendado para la vacunación.
--Los datos disponibles sobre la administración de la-vacuna son actualmente insuficientes para permitir la evaluación de la eficacia o seguridad de esta frente a las personas que viven con el VIH que no están bien controladas con la terapia. Es posible que la respuesta inmunitaria a la vacuna se reduzca, lo que puede alterar su eficacia.
--Se debe proporcionar información y, cuando sea posible, asesoramiento sobre los perfiles de eficacia y seguridad de las vacunas en personas inmunodeprimidas para fundamentar la evaluación individual de los riesgos y beneficios. No es necesario realizar una prueba de infección por VIH antes de la administración de la vacuna.
Personas inmunodeprimidas
--Las personas inmunodeprimidas tienen un mayor riesgo de contraer COVID-19 grave.
--Actualmente, los datos disponibles son insuficientes para evaluar la eficacia de la vacuna o los riesgos asociados a la vacuna en personas gravemente inmunodeprimidas.
--Es posible que la respuesta inmunitaria a la vacuna se reduzca, lo que puede alterar su eficacia.
--La vacuna no es un virus vivo, las personas inmunodeprimidas que forman parte de un grupo recomendado para la vacunación pueden vacunarse.
--Se debe proporcionar información y, cuando sea posible, asesoramiento sobre los perfiles de eficacia y seguridad de las vacunas en personas inmunodeprimidas para fundamentar la evaluación individual de los riesgos y los beneficios.
Personas que han tenido previamente una infección por SARS-CoV-2
--No se recomiendan las pruebas virales o serológicas para detectar una infección previa con el fin de tomar decisiones sobre la vacunación.
--Los datos de los análisis combinados indican que la vacuna es segura en personas con evidencia de infección previa por SARS-CoV-2.
--Las personas con antecedente de COVID-19 confirmado, en el marco del PNV contra la COVID- 19 serán vacunadas noventa (90) días contados a partir del inicio de síntomas en personas sintomáticas y a partir de la toma de muestra en personas asintomáticas.
Personas con COVID-19 agudo actual
--Las personas con COVID-19 aguda confirmada por PCR no deben vacunarse hasta que se hayan recuperado de la enfermedad aguda y se hayan cumplido los criterios para la interrupción del aislamiento. Aún no se conoce el intervalo óptimo entre una infección natural y la vacunación.
Personas que previamente recibieron terapia con anticuerpos pasivos para la COVID-19.
--Actualmente no hay datos sobre la seguridad o eficacia de la vacunación en personas que recibieron anticuerpos monoclonales o plasma de convalecencia como parte del tratamiento con COVID-19.
--La vacunación debe posponerse durante al menos 90 días para evitar la interferencia del tratamiento con anticuerpos con las respuestas inmunitarias inducidas por la vacuna.
Reacciones adversas esperadas (2,5)
--Según el resumen del perfil de los estudios de seguridad de la vacuna Moderna ARNm-1273, las reacciones adversas notificadas con más frecuencia fueron tanto las locales como las sistémicas; más con la segunda dosis: dolor en el lugar de la inyección (92%), fatiga (70%), cefalea (64,7%), mialgia (61,5%), artralgia (46,4%), escalofríos (45,4%), náuseas/vómitos (23%), hinchazón/sensibilidad axilar (19,8%), fiebre (15,5%), edema en el lugar de la inyección (14,7%) y enrojecimiento (10%). Las reacciones adversas fueron, por lo general, de intensidad leve o moderada y se resolvieron entre 4 y 5 días después de la vacunación, donde se enrolaron participantes mayores de 18 años. En las personas de mayor edad se asoció a una frecuencia ligeramente menor de acontecimientos de reactogenicidad.
--La frecuencia de eventos adversos de grado 3 en el grupo de placebo (1,3%) fue similar a la del grupo de vacuna (1,5%), al igual que las frecuencias de eventos adversos atendidos médicamente (9,7% frente a 9,0%) y eventos adversos graves (0,6% en ambos grupos).
--Se informaron reacciones de hipersensibilidad en el 1,5% y el 1,1% de los participantes en los grupos de vacuna y placebo, respectivamente.
--Parálisis de Bell se produjo en el grupo de la vacuna (3 participantes (<0,1%)) y el grupo de placebo (1 participante (<0, 1 %)) durante el periodo de observación del ensayo (más de 28 días después de la inyección).
--En general, el 0,5% de los participantes en el grupo de placebo y el 0,3% en el grupo de ARNm- 1273 tuvieron eventos adversos que provocaron que no recibieran la segunda dosis, y menos del 0,1% de los participantes de ambos grupos interrumpieron su participación en el ensayo por eventos adversos después de cualquier dosis.
--No se observó evidencia de enfermedad respiratoria aumentada asociada a la vacuna.
--Se observaron menos casos de COVID-19 grave o cualquier COVID-19 entre los participantes que recibieron ARNm-1273 que entre los que recibieron placebo. Los eventos adversos que el equipo del ensayo consideró que estaban relacionados con la vacuna o el placebo se informaron entre el 4,5% de los participantes en el grupo de placebo y 8,2% en el grupo ARNm-1273.
Sobredosis
No se han notificado casos de sobredosis. En caso de sobredosis, se recomienda vigilar las funciones vitales y un posible tratamiento sintomático.
Interacción con otros medicamentos y otras formas de interacción
--No se han realizado estudios de interacción. No se ha estudiado la administración concomitante de la vacuna de ARNm-1273 con otras vacunas.
--No mezclar la vacuna ARNm-1273 con otras vacunas / productos en la misma jeringa.
Efectos sobre la capacidad para conducir y utilizar máquinas
La vacuna Moderna ARNm-1273 tiene una influencia nula o insignificante sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunas de las reacciones adversas pueden afectar temporalmente a la capacidad para conducir o utilizar máquinas.
Vacunación segura
Antes de recibir la vacuna Moderna ARNm-1273 debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo si usted:
--Tiene alguna alergia. Es importante indagar al usuario si ha presentado reacción alérgica grave.
--Si alguna vez se ha desmayado después de una inyección con aguja.
--Tiene fiebre
--Tiene problemas de hemorragia o hematomas, o si está tomando un medicamento anticoagulante (para prevenir la formación de coágulos de sangre).
--Si su sistema inmunológico no funciona correctamente (inmunodeficiencia) o si está tomando medicamentos que debilitan el sistema inmunológico (como corticosteroides en dosis altas, inmunosupresores o medicamentos contra el cáncer).
--Ha recibido otra vacuna contra la COVID-19
--En caso de ser mujer en edad reproductiva preguntar:
-Está embarazada o planea quedar embarazada
-Está amamantando
--Ha recibido otra vacuna contra la COVID-19
Nota: Ver ítem contraindicaciones
Referencias
1. Wang F, Kream RM, Stefano GB. An evidence based perspective on mRNA-SARS-CoV-2 Vaccine Development. Med Sci Monit. 2020;26:1-8.'
2. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccíne. N Engl J Med. 2020;403-16.
3. World Health Organization. Interim recommendations for use of the Moderna mRNA-1273 vaccine against COVID-19 2021;(January): 1-8. Available from:
https://apps.who.int/iris/bitstream/handle/10665/338862/WHO-2019-nCoV-vaccines-SAGE_recommendation-mRNA-1273-2021.1-eng.pdf?sequence=1&isAllowed=y
4. World Health Organization. Interim recommendations for use of the Moderna mRNA-1273 vaccine against COVID-19. Update 15 June. World Heal Organ [Internet], 2021;1-11. Available from: WHO/2019-nCoV/vaccines/SAGE_recommendation/BNT 162b2/2021.1
5. Invima. Resolución No. 2021025857 de 25 de Junio de 2021. Autorización Sanitaria de Uso de Emergencia (ASUE) para la COVID-19 Vaccíne Moderna Switzerland GMBH. 2021;1 –20.
6. Centers for Disease Control Prevention. Interim Clinical Considerations for Use of mRNA COVID-19 Vaccines Currently Authorized in the United States [Internet]. 2021 [cited 2021 Jan 18], Available from: https://www.cdc.gov/vaccines/covid-19/info-by-product/clinical- considerations.html?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fvaccines%2Fcovid-19%2Finfo-by-product%2Fpfizer%2Fclinical-considerations.html#Administration
7. Dirección General de Salud Pública (Consejería de Sanidad). Anexo 2. Vacuna COVID-19 ARNm, Moderna. Comunidad de Madrid. 2021; 1–9.
8. European Medicines Agency (EMA). Ficha técnica o resumen de las características del producto COVID-19 Vaccine Moderna. 2021;1-27.
9. Food and Drug Administration. Fact sheet for healthcare providers administering vaccine (vaccination providers) emergency use authorization (EUA) of The moderna COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19). 2020;1-22. Available from: https://search.bvsalud.org/global-literature-on-novel-coronavirus-2019-ncov/resource/en/grc- 740221
10. Instituto Nacional de Salud-Grupo de enfermedades transmisibles. Farmacovigilancia de vacunas. (Evento adverso posterior a la vacunación). Código: 298 Equipo de inmunoprevenibles. [Internet], 2021. Available from: https://www.ins.gov.co/buscador- eventos/lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf





